

吲哚胺2,3-双加氧酶1(IDO 1)是一种色氨酸代谢酶,参与免疫细胞分化/成熟和肿瘤生物学。IDO 1在心肌细胞中也有表达,但其在心血管系统中的作用尚不完全清楚。本文报道了IDO 1在心肌肥厚中的作用。定量实时PCR和westernblot实验显示IDO 1人和肥大小鼠心脏以及血管紧张素Ⅱ(AngⅡ)诱导的心肌细胞中mRNA和蛋白水平的变化。IDO 1活性和代谢产物kynurenine在啮齿动物肥厚心脏和心肌细胞中均升高。PF-06840003抑制IDO 1活性可减轻AngⅡ诱导的小鼠心肌肥厚和心功能恢复。SiRNA介导的基因敲除偶像1抑制AngⅡ诱导的心肌细胞生长及肥大相关基因的过度表达心钠素 (ANP或NPPA), 脑利钠肽 (BNP或Nppb), β-肌球蛋白重链 (β-MHC或Myh 7)。相比之下,腺病毒介导的大鼠偶像1IDO 1过表达与PI3K-AKT-mTOR信号转导有关,激活核糖体蛋白S6激酶1(S6K1),促进AngⅡ诱导的心肌细胞肥大的蛋白质合成。最后,我们提供了证据表明,PI3K与比利特,AKT和雷帕霉素的抑制作用,阻断了IDO 1对AngⅡ处理细胞蛋白质合成和心肌细胞肥大的影响。总之,我们的发现发现IDO 1通过PI3K-AKT-mTOR-S6K1信号通路部分促进心肌细胞肥大。
导言
心血管疾病已经成为全世界人类死亡的主要原因。在心血管疾病中,心脏重塑在人类患者中很常见。1]。心脏重塑可导致心律失常、心肌梗死和心力衰竭。心肌肥厚是心脏重塑的标志之一,参与各种心脏疾病的发生。2]。心肌细胞是终末分化细胞,很少增殖.在损伤应激下,心肌细胞不能增殖而对心脏损伤作出反应。相反,心肌细胞会发生肥大生长。这些细胞表达胎儿标记物,如心钠素(ANP)、脑钠素(BNP)和β-肌球蛋白重链(MYH 7)。3]。高血压、神经内分泌因子和心肌梗死可诱导心肌细胞肥大生长,支持心肌组织的需求增加。4]。重要的是,心肌肥大被认为是治疗心力衰竭等心脏疾病的一个有希望的靶点。2,3,4]。然而,我们对心肌肥大的机制还不完全了解。这一事实可能会推迟治疗药物的开发。
心脏是一个需要大量能量的器官,心肌细胞的代谢模式与其他细胞类型有很大不同。5, 6]。心肌细胞的肥大生长受到代谢调节剂如AMP依赖性蛋白激酶(AMPK)的重要调节。7, 8]、NAD+-依赖型sirtuins[9, 10]、哺乳动物雷帕霉素靶标(MTOR)[11, 12和FOXO[13, 14]。例如,AKT-mTOR信号是心肌肥大的重要调节因子[15]。各种刺激可激活磷酸肌醇3-激酶(PI3K)-AKT的激活.细胞外基质的机械应激、衰老、内分泌因子、胰岛素等可触发PI3K,导致激酶AKT的激活。16]。AKT在心脏生理和病理过程中起着至关重要的作用。在心肌肥厚过程中,AKT的激活可导致下游mTOR的过度激活,进而激活p70核糖体蛋白S6激酶1(S6K1)[17]。MTOR-S6K1信号通路是控制器官大小的重要调节因子,通过其对新生蛋白合成的影响参与心肌肥厚,这是心肌细胞肥大的重要进展。18]。因此,AKT-mTOR信号通路被认为是治疗心肌肥大的有效靶点.但对AKT-mTOR信号通路在肥厚应激中的调控尚不完全清楚.
吲哚胺2,3-双加氧酶1(IDO 1)通过其在色氨酸分解代谢中的生化功能参与免疫代谢和炎症过程。19]。越来越多的研究已经探讨了IDO 1在免疫细胞中的作用。IDO 1参与了多种临床前人类癌症模型的免疫抑制作用。例如,浸润的T细胞促进胶质母细胞瘤细胞IDO 1的表达,从而导致患者生存下降。20]。IDO 1和kynurenine途径代谢物促进结肠癌上皮PI3K-AKT信号通路的激活,抑制细胞凋亡,促进癌细胞增殖。21]。抑制IDO 1与PD-1(程序性死亡1)阻断和辐射可持续增加晚期胶质母细胞瘤的存活率[20, 22]。一些研究也报道了IDO 1在心血管系统中的作用。例如,来自IDO 1-高表达骨髓间充质干细胞(BMMSCs)的外显子促进了大鼠心脏移植物的免疫耐受[23]。此外,IDO 1通过调节ERK 1/2激酶抑制白细胞介素-10(IL-10)的产生,在动脉粥样硬化过程中通过调节免疫稳态。24]。此外,巨噬细胞IDO 1缺乏可引起小鼠慢性病毒性心肌炎的抗炎反应[25]。二十碳五烯酸通过IDO 1调节低密度脂蛋白受体缺陷小鼠树突状细胞表型,抑制动脉粥样硬化。26)..。此外,表达IDO 1的主动脉浆细胞样树突状细胞通过引入调节性T细胞保护其抗动脉粥样硬化[27]。床边、内皮细胞IDO 1通过金牛柳碱改变心肌梗死后心功能[28]。这些发现提示IDO 1在心血管组织中的重要作用。然而,IDO 1是否参与心肌肥厚及其机制尚不清楚。
材料和方法
人体样本
2011年1月至2017年12月,在佳木斯大学第一附属医院采集了新鲜的人体心脏样本。本研究共收集了5例心肌肥厚患者和5例健康对照者。对照组为非衰竭心脏,行心室矫形手术或供体心脏功能不全。取新鲜心脏组织,在使用前将其保存在液氮中。每个病人或捐献者都签署了一份书面形式的知情同意书,仅供研究使用他们的组织。本研究的设计和实验方案已通过佳木斯大学第一附属医院临床研究伦理共同体的批准。病人资料载於表内。1.
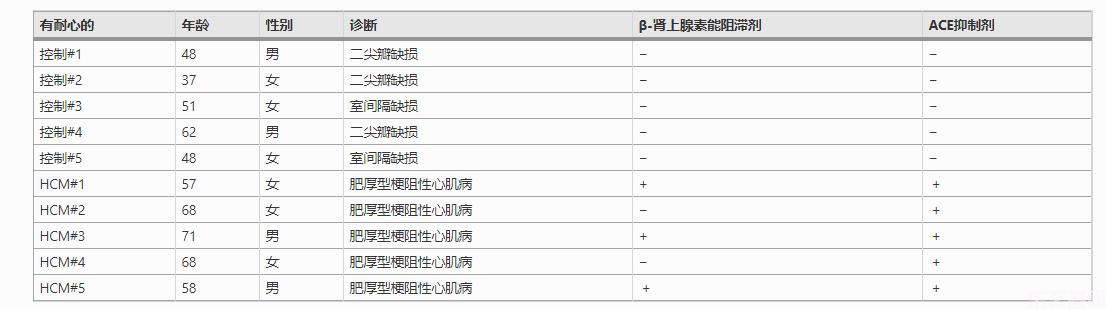
表1病人资料
小鼠心肌肥大模型
所有动物在SPF条件下饲养,并可免费获得食物和水。动物维持正常的12小时光/暗周期。采用上述方案,慢性皮下注射AngⅡ(1.3mg/kg/d,共14或28天;Sigma)诱导小鼠心肌肥厚。10]。对于PF-06840003(Selleckchem)治疗,I.P.PF-06840003(200 mg/kg/d),每日1次,连续2周。用异氟醚麻醉小鼠,并在循环热水垫上保持体温。超声心动图检查证实心肌组织肥厚生长,心脏重量增加,肥大相关基因过度表达。如上文所述,进行超声心动图检查,以确定缩短分数和射血分数[29]。用颈椎脱位法处死小鼠,按上述方法进行H&E染色。10]。动物实验在河北医科大学动物中心进行。动物研究的设计和规程已获得佳木斯大学动物研究伦理团体的批准(#JMSU 2018006)。
新生大鼠心肌细胞的分离与培养
新生大鼠心肌细胞是从1~3天的Sprague Dawley大鼠中分离出来的。30]。动物研究的设计和规程已获得佳木斯大学动物研究伦理团体的批准(#JMSU 2017011)。大鼠用异氟醚麻醉,颈脱位法处死。用胶原酶(Sigma)和胰蛋白酶(吉布CO)消化左心室心肌组织,制备单细胞。然后将单个细胞预镀2h,以5%的CO去除成纤维细胞。2然后,将心肌细胞培养在Dulbecco改良鹰培养基(DMEM)中,加入10%胎牛血清(FBS,吉布co)和1%青霉素链霉素(吉布CO),加入5%CO。237℃后再使用。
心肌细胞肥大的细胞模型
用AngⅡ、异丙肾上腺素(ISO,Sigma)和苯肾上腺素(PE,Sigma)诱导心肌细胞肥大。将心肌细胞置于含1%FBS的DMEM培养基中培养24h,然后加入ANGII(1μM)、PE(50μM)、ISO(30μM)诱导心肌细胞肥大。心肌细胞的肥大生长是由心肌细胞大小的增加和肥大相关的胎儿基因的过度表达所证实的。心肌细胞用α-肌动蛋白(Sigma)染色,用ImageJ软件分析细胞大小。从Selleck购买PI3K抑制剂(PI3K抑制剂;100μM;AKT抑制剂;1μM);雷帕霉素(mTOR抑制剂;10 NM);MHY1485(mTOR激活剂;10μM)。
基因沉默与过度表达
对于基因沉默,siRNA被用于靶向。偶像1在大鼠心肌细胞中。西-偶像1(5ʹ-GGCTTTCTCTCCACACAT-3ʹ)和阴性对照siRNA(si-NC,5ʹ-CAGCGCAGCCUGAAUG-3ʹ)分别用脂质体介导的RNAiMax(Invitrogen)转染细胞24或48h。基因过表达,大鼠偶像1将表达载体克隆到腺病毒系统载体中。该腺病毒是在HEK293A细胞中用前面描述的方法产生的[31]。表达腺病毒的心肌细胞感染偶像1(广告-偶像1)或在其他治疗前控制腺病毒(Ad-Ctrl)24或48小时。
定量实时PCR
用TRIzol试剂(Byeotime)提取培养细胞或心脏组织中的总RNA。然后,利用μ合成试剂盒,用一株g总RNA合成了第一株cDNA。接下来,我们用SYBR Green II试剂盒(Takara)进行了定量实时PCR(RT-qPCR)实验,以检测靶mRNA的表达水平。本研究中使用的rt-qPCR引物见表。
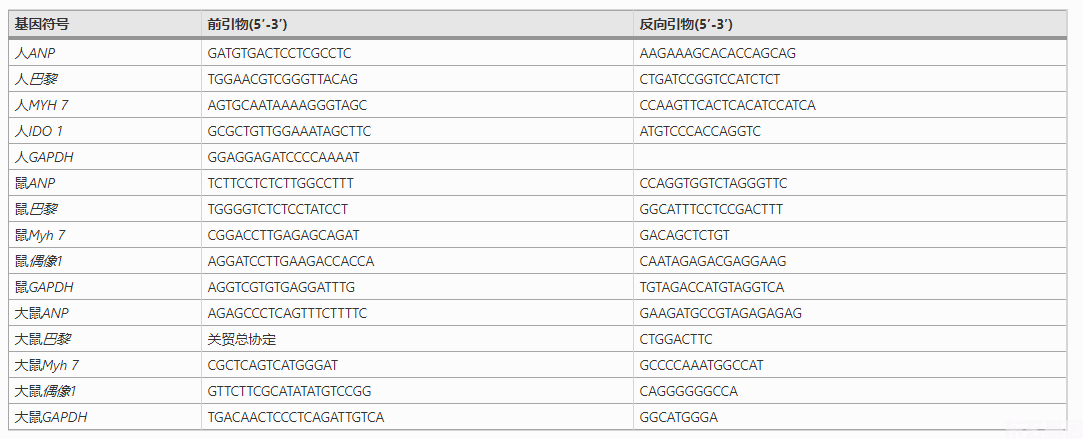
本研究中使用的rt-qPCR引物
西布洛
培养细胞或心脏组织用RIPA裂解缓冲液和蛋白酶抑制剂鸡尾酒(Biomake)提取总蛋白。其次,进行标准Westernblot,根据先前研究中修改的协议,确定感兴趣的蛋白质水平[31, 32]。用于Westernblot检测的主要抗体如下:
抗-IDO 1抗体(ABCAM;1:1000),抗GAPDH抗体(蛋白技术;1:2000),抗-pKT抗体(细胞信号技术;1:1000),抗-AKT抗体(细胞信号技术;1:1000),抗pmTOR抗体(细胞信号技术;1:1000),抗-mTOR抗体(细胞信号技术;1:1000),抗-pS6K1抗体(细胞信号技术,1:1000),抗-S6K1抗体(细胞信号技术;1:1000)。次级抗体(1:5000)和ECL试剂盒是从Servicebio购买的。
蛋白质合成试验
通过测定[+H]-在以前的工作中描述到心肌细胞中的亮氨酸掺入[33].
IDO 1活性测定
根据操作手册用IDO 1活性测定试剂盒(ABCAM,ab235936)测定IDO 1活性。
金牛柳碱水平
按操作手册用苦参碱(Kyn)ELISA试剂盒(Abbexa,abx 585209)测定Kyn水平。
统计分析
所有的数值都显示为至少三个独立重复实验的平均±SD。为了分析两组学生的差异,标准学生t测试是用的。对两组以上患者的差异进行单因素或双向方差分析(ANOVA),然后进行土耳其自评后检验。所有的统计分析都是用GraphPad Prism软件8进行的,并且P小于0.05的数值被认为是有统计学意义的。
结果
IDO 1在肥厚心脏中的表达和活性上调
Ido是一种色氨酸分解代谢酶,参与免疫应答和肿瘤生物学。IDO 1在心肌肥厚中的作用尚不清楚。我们监测了IDO 1在人和啮齿类动物肥厚心脏组织中的表达。本研究包括5例肥厚心脏和5例对照心脏。肥大相关胎儿基因的过度表达证实了人心脏的肥大表型,包括ANP, BNP,和MYH 7(补充图1)。QRT-PCR和westernblot分析表明,与对照组相比,IDO 1 mRNA和蛋白水平在肥厚心脏中的表达明显上调(图2)。1a,b)。因此,IDO 1在人肥厚心脏中过度表达。
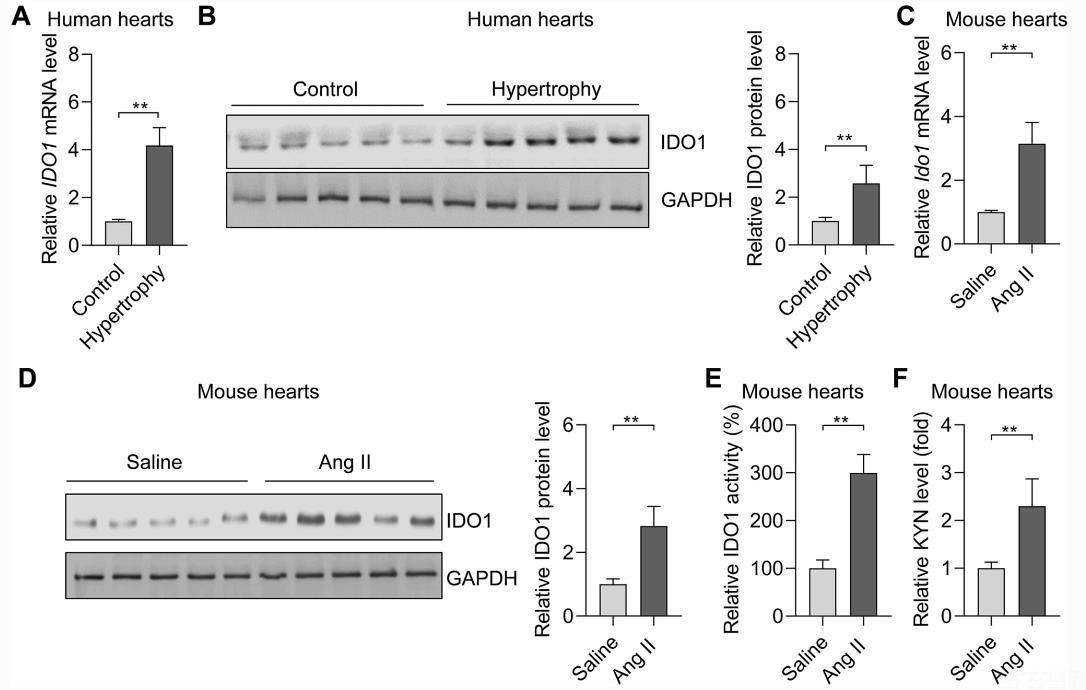
长期皮下注射AngⅡ28d,可诱导小鼠心肌肥厚。心脏功能下降,心脏重量和心肌细胞体积增加,证实了小鼠心肌肥大的表型(补充图2A-c)。此外,肥大相关胎儿基因的过度表达ANP, 巴黎,和Myh 7)在小鼠心肌肥大模型中也得到证实(补充图2D)。我们一致地观察到偶像1RT-qPCR和Westernblot在肥大小鼠心脏中的应用(图)。1c,d)。此外,我们还测试了IDO 1及其代谢产物kynurenine的活性。结果表明,在肥厚小鼠心脏中,IDO 1活性和Kynurenine水平显著升高。1E,f)。
我们分离新生大鼠心肌细胞,用AngⅡ诱导心肌细胞肥大。AngⅡ(1μM,48 h)显著上调肥大相关胎儿基因的表达。ANP, 巴黎,和Myh 7)大鼠心肌细胞(补充图2e)。值得注意的是,AngⅡ治疗增加了大鼠的mRNA和蛋白水平。偶像1在大鼠心肌细胞中。2a,b)。此外,偶像1在异丙肾上腺素(ISO,30μM,48 h)和苯肾上腺素(PE,50μM,48 h)诱导的肥厚心肌细胞中也得到证实。2c)。此外,我们还测试了IDO 1及其代谢产物kynurenine的活性。结果表明,在肥厚型心肌细胞中,IDO 1活性和Kynurenine水平显著升高。2D,e)。因此,IDO 1在心肌肥大中的过度表达发生在心肌细胞中。
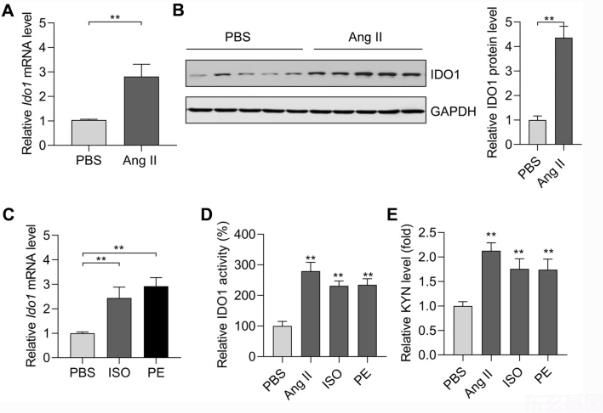
综上所述,这些发现表明IDO 1在不同物种的肥厚心脏中过度表达,提示IDO 1可能参与心肌肥大。
IDO 1促进心肌细胞肥大的体内外研究
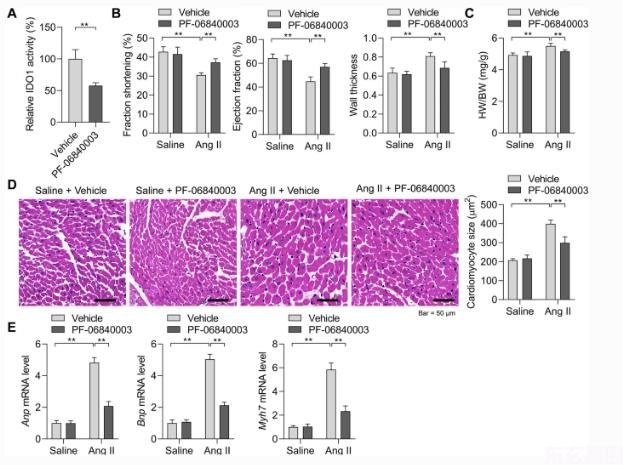
以上结果提示IDO 1在心肌肥厚过程中的过度表达可能调控心肌细胞的肥大生长。我们首先用PF-06840003抑制IDO 1的活性,检测IDO 1在AngⅡ诱导的心肌肥厚中的作用。在PF-06840003存在或不存在的情况下,用AngⅡ诱导2周小鼠心肌肥厚。PF-06840003可显著降低小鼠心脏组织中IDO 1的活性。3a)。我们观察到AngⅡ所致的缩短率和射血分数的下降被IDO 1抑制所逆转,而壁厚则因IDO 1的抑制而降低(图一)。3b)。血管紧张素Ⅱ引起的心脏重量增加也被PF-06840003治疗所抑制。3c)。组织学分析显示,PF-0680003能显著降低AngⅡ诱导的心肌细胞体积增大,抑制肥大胎儿基因的表达。3D,e)。IDO 1抑制抑制病理性心肌肥厚。
为了测试ido 1是否直接调节心肌细胞肥大,我们首先击倒了。偶像1在心肌细胞中含有siRNA(如图所示)。4a)。有趣的是,偶像1敲除抑制AngⅡ治疗后心肌细胞大小的增加(图二)。4b)。另外,偶像1缺乏症也减少了.的表达。ANP,BNP,和Myh 7AngⅡ在心肌细胞中的触发(图)。4c)。因此,损失偶像1导致心肌细胞肥大的抑制。研究是否偶像1过度表达导致心肌细胞肥大,我们产生携带腺病毒的大鼠。偶像1。腺病毒介导的大鼠超表达偶像1在心肌细胞中,qRT-PCR和westernblot证明了这一点。4d)。我们发现偶像1过度表达促进了AngⅡ对心肌细胞大小增加的影响(如图所示)。4e)。此外,过度表达偶像1促进心肌细胞过度表达ANP, BNP,和Myh 7(无花果)4f)。因此,偶像1过表达促进心肌细胞肥大。
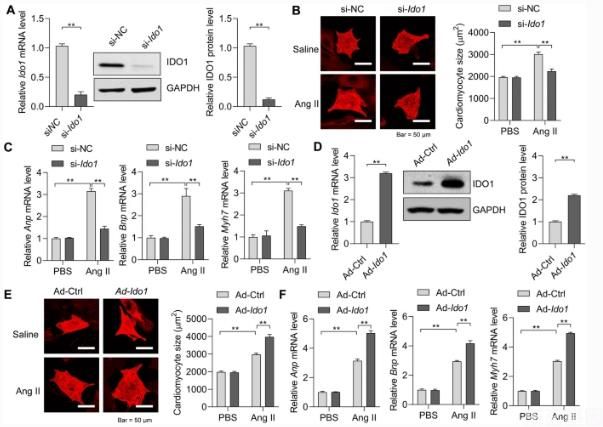
这些发现表明IDO 1在体内和体外都是心肌细胞肥大的正调节因子。
IDO 1促进AKT-mTOR信号转导促进蛋白质合成
接下来,我们试图确定IDO 1参与心肌细胞肥大的潜在机制。AKT-mTOR是心肌细胞肥大的重要调节因子,多种肥大刺激可增加AKT-mTOR信号的激活。2, 11, 17]。MTOR是细胞器官大小和肥大生长的关键调节因子[11]。为了检测IDO 1是否通过AKT-mTOR信号通路调节心肌细胞肥大,我们检测了IDO 1对AngⅡ处理心肌细胞AKT和mTOR激活(磷酸化)的影响。Westernblot结果显示siRNA介导的偶像1敲除可降低AKT和mTOR的磷酸化水平(图1)。5a)。相比之下,腺病毒介导的偶像1AngⅡ处理后心肌细胞AKT和mTOR磷酸化增强(图二)。5b)。此外,IDO 1还促进mTOR下游效应因子p70核糖体蛋白S6激酶1(S6K1)的磷酸化。5a,b)。
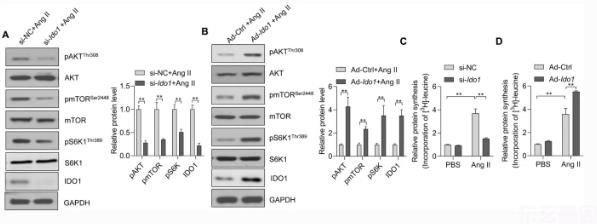
核糖体蛋白S6K1在新蛋白合成中起着关键作用,并参与了mTOR在细胞大小调控中的作用。11]。越来越多的证据表明,蛋白质合成增加是体外心肌细胞肥大和体内心肌肥大的一个基本特征。33, 34]。此外,AKT-mTOR-S6K1信号轴是蛋白质合成及随后心肌肥大的关键调控因子。18, 35, 36]。因此,我们检测了IDO 1对AngⅡ诱导的心肌细胞蛋白质合成的影响。3-亮氨酸掺入法。我们观察到AngⅡ处理能显著提高心肌细胞的蛋白质合成水平,而sirna介导的蛋白合成受到抑制。偶像1腺病毒介导的缺陷和增强偶像1过度表达(图1.5c,d)。因此,这些结果表明IDO 1通过激活AKT-mTOR-S6K1信号轴,促进AngⅡ诱导的新蛋白合成。
AKT-mTOR信号与IDO 1在心肌肥厚中的作用
接下来,我们测试了AKT-mTOR信号是否参与了IDO介导的蛋白质合成,进而参与了心肌细胞的肥大生长。为此,我们用AKT抑制剂来处理细胞。6a)。AKT抑制剂倍福辛显著阻断偶像1AngⅡ处理心肌细胞蛋白质合成的研究6b)。此外,偶像1增加心肌细胞大小和肥大基因的表达。ANP, BNP,和Myh 7)也受到AKT抑制剂的抑制。6c,d)。因此,激酶AKT对IDO 1在蛋白质合成和心肌细胞肥大中的作用至关重要。
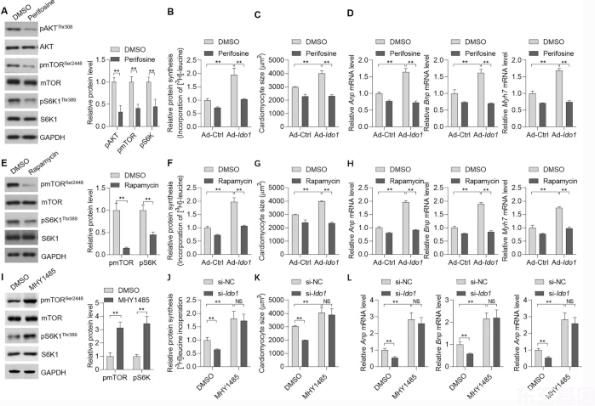
最后,我们还用雷帕霉素抑制mTOR。6e)。雷帕霉素处理降低了雷帕霉素的促进作用偶像1蛋白质合成的过度表达(图。6f)。此外,雷帕霉素也抑制了偶像1心肌细胞大小及肥大基因的表达ANP, 巴黎,和Myh 7)(图1.6G,h)。有趣的是,MHA 1485激活mTOR可促进AngⅡ诱导的心肌细胞肥大,并阻断其对心肌细胞肥大的影响。偶像1击倒(图)6我-我)。因此,这些发现表明AKT-mTOR信号在IDO 1介导的控制蛋白合成和心肌细胞肥大中起着关键作用。
IDO 1促进PI3K活化促进AKT-mTOR信号转导和心肌细胞肥大
最后,我们分析了IDO 1促进AKT-mTOR激活的机制。PI3K是AKT的关键上游激活因子[4]。我们探讨PI3K是否参与IDO 1介导的AKT激活。分析IDO 1基因敲除和过表达对PI3K磷酸化的影响。我们发现IDO 1基因的敲除抑制了PI3K的磷酸化,而IDO 1的过表达增强了PI3K的磷酸化,提示IDO 1激活了PI3K。7a)。其次,我们用PI3K及其抑制剂Pictilsib(补充图3)来抑制PI3K,我们观察到,苦参碱治疗能显著阻断IDO 1诱导的AKT-mTOR激活(图3)。7b)。我们还分析了白癜风对蛋白质合成的影响。结果表明,苦参碱可抑制IDO 1介导的AngⅡ处理心肌细胞蛋白质合成的上调(图一)。7c)。最后,我们测试了比西布对心肌细胞肥大的影响。我们发现,比西布能阻断ido 1对心肌细胞大小和肥大相关胎儿基因表达的影响。ANP,BNP,和Myh 7(无花果)7D,e)。因此,这些结果表明PI3K介导IDO 1对AKT-mTOR和心肌细胞肥大的影响。
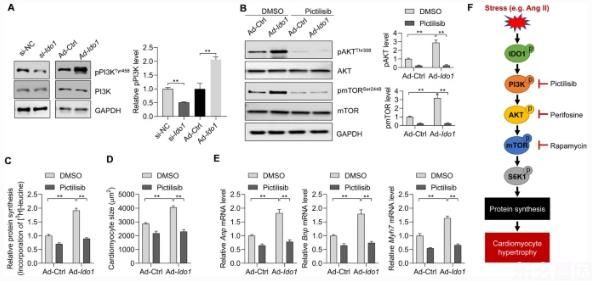
讨论
在本研究中,我们发现IDO 1是心肌肥大的重要调节因子。IDO 1在人、小鼠及肥厚大鼠心肌细胞中的表达和活性均显著升高。基因沉默和过表达实验表明,IDO 1通过AKT-mTOR-S6K1信号轴激活蛋白合成途径,促进心肌细胞肥大。药理研究表明,AKT和mTOR与IDO 1在蛋白质合成和心肌细胞肥大中的作用有关。7f)。
IDO 1是一种参与色氨酸分解代谢的限速酶,参与免疫激活、肿瘤发展和耐药。19, 22, 37]。IDO 1在心血管系统中的作用最近也被确认。大鼠骨髓间充质干细胞IDO 1的过表达调节外显子成分,促进大鼠心脏移植物的免疫耐受23]。在小鼠慢性病毒性心肌炎中,偶像1基因敲除诱导巨噬细胞抗炎反应25]。此外,据报道IDO 1可调节巨噬细胞产生IL-10,并参与动脉粥样硬化。IDO 1来源的代谢物kynurenacid通过激活cAMP依赖的途径和ERK 1/2的抑制作用,减少IL-10的产生。24]。以往的研究主要集中在IDO 1在心血管系统中的干细胞和免疫细胞中的作用。但IDO 1在心肌细胞中的作用尚不清楚。
在此,我们发现IDO 1是心肌肥大的关键调节因子。IDO 1 mRNA和蛋白在肥厚心脏和心肌细胞中均有过表达。值得注意的是,这种IDO 1在肥厚心脏中的表达增加是在不同物种(人类、小鼠和大鼠)之间保存的。结果表明,IDO 1在体内外均能促进AngⅡ诱导的心肌细胞肥大的发展。因此,我们发现IDO 1是心肌细胞功能的关键,IDO 1的过度表达是心肌细胞肥大的重要因素。在AngⅡ处理条件下,IDO 1的异常调控促进了心肌细胞肥大的发生,但IDO 1的过度表达并不能促进心肌细胞的肥大。提示IDO 1是心肌细胞肥大的乘客因子,而不是驱动因子。
IDO 1是一种限速酶,能催化色氨酸沿kynurenine途径的降解[21]。色氨酸是蛋白质合成所必需的。37]。心肌细胞肥大的特征之一是蛋白质合成的增加。2]。肥大的各种刺激(如AngⅡ)可诱导蛋白质合成。在此,我们发现AngⅡ诱导的心肌细胞肥大时蛋白质合成增加.有趣的是,我们的数据显示偶像1击倒偶像1过表达促进AngⅡ-增加蛋白质合成。因此,IDO 1可能在调节色氨酸降解和蛋白质合成方面起着复杂的作用,这两种途径的机制有很大的不同。
IDO 1可直接催化色氨酸沿尿氨酸途径的降解[19]。相比之下,IDO 1在调节蛋白质合成中的作用可能是间接的。IDO 1促进心肌细胞肥大时AKT-mTOR信号通路的激活。AKT-mTOR是营养物质的重要应答者,通过核糖体蛋白S6K1参与蛋白质合成。我们观察到S6K1在心肌细胞中也受到IDO 1的调节。值得注意的是,我们观察到AKT和雷帕霉素抑制AKT或mTOR对心肌细胞蛋白合成和肥大生长的抑制作用。因此,AKT-mTOR-S6K1信号轴是IDO 1调控肥厚心肌细胞蛋白质合成的关键。我们还提供了证据,证明IDO 1对AKT激活的作用依赖于PI3K的激活,而PI3K被证明是IDO 1代谢产物如kyn[21]。因此,IDO 1可能通过kyn-PI3K信号通路激活AKT-mTOR信号通路。此外,我们的发现和先前的研究表明IDO 1对癌细胞的PI3K-AKT-mTOR信号有调节作用。21, 38]。因此,IDO 1可能参与其他生物进展,如涉及PI3K-AKT-mTOR信号的胰岛素抵抗。需要进一步的研究来验证这一假设。
总之,IDO 1通过PI3K-AKT-mTOR-S6K1信号轴和蛋白质合成参与了心肌细胞的跨种肥大。本研究还提示IDO 1可能参与心肌肥厚和心力衰竭的发生,IDO 1可作为治疗心肌肥厚及相关心力衰竭的理想靶点。
本研究的局限性
所使用的人体样本是基于不同性别和不同治疗方法的患者,这可能是对建议结果的混淆因素。此外,我们没有测试IDO 1在体内心肌肥大中的作用。利用IDO 1基因敲除小鼠或IDO 1抑制剂,进一步研究IDO 1在小鼠心肌肥厚中的体内功能。