

基因组编辑的最新进展,特别是CRISPR-CA核酸酶,已经彻底改变了实验室研究和临床治疗。CRISPR-Cas核酸酶结合细胞DNA损伤修复途径,通过经典的非同源末端连接(c-NHEJ)和基于同源修复(HBR)的精确基因组修饰,实现了基因的多样化。合子基因组编辑是编辑生殖细胞的一种方便的方法,为动物疾病模型的产生以及人类胚胎基因组编辑治疗一些危及生命的不治之症铺平了道路。HBR效率很大程度上取决于作为修复模板的DNA供体。本文就通过设计合适的DNA供体来改善CRISPR-CaS核酸酶诱导的哺乳动物胚胎HBR的研究进展作一综述。此外,我们希望通过CRISPR-Cas核酸酶诱导哺乳动物胚胎HBR,为动物疾病模型的建立和基因突变的纠正提供指导。最后,我们讨论了基于CRISPR-CAS系统的精确基因组修饰技术的最新进展。 基因组编辑,能够重写DNA序列原地具有巨大的研究和临床应用潜力。动物胚胎基因组编辑提供了一种产生基因组修饰哺乳动物(如小鼠、大鼠、兔子、猪和猴子)的有效途径,在疾病建模和精确医学方面具有巨大的潜力(Anzone等人)。2020杜德娜2020)。此外,人类胚胎基因组编辑一旦与人类胚胎基因组编辑有关的技术、安全、伦理、社会和法律问题得到解决,就可能成为防止遗传病传播和拯救生命的一种选择(巴尔的摩等人,2015罗莎特,2018麦金托什2019).
自从上世纪90年代第一次用巨核酶编辑基因组的报告以来(Rouet等人,1994;Chou利卡等人,1995)、锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)和定期排列的短回文重复序列(CRISPR)-CRISPR相关核酸酶(CRISPR-Cas)已用于基因组编辑(Urnov等人)。2010;Gaj等人,2013)。在这四种基因组编辑工具中,CRISPR-Cas核酸酶是最方便、最经济、最通用、最健壮的工具(Anzone等人)。2020)。CRISPR-Cas核酸酶(如Cas9、Cas12a、Cas12b和CasX)来源于细菌和古菌的适应性免疫系统,是由引导RNA(GRNA)和Cas蛋白(Jinek等)组成的RNA-蛋白质复合物。2012;Cong等人,2013马里等人,2013)。GRNA-Cas复合物搜索目标DNA,包括原生质体相邻基序(PAM)和与gRNA互补的序列(Sternberg等人),2015;蒋等人,2016;Palermo等人,2016, 2017;Chen等人,2017)。GRNA对末端与靶DNA的互补链(或命名靶链)的引导序列,导致CRISPR-Cas核酸酶激活和DNA双链断裂(DSBs)(Sternberg等人)。2015;蒋等人,2016;Palermo等人,2016, 2017;Chen等人,2017)。CRISPR-Cas核酸酶产生的DNA DSBs可以通过经典的非同源端连接(c-NHEJ)或同源定向修复(HBR)进行修复。1)(Cong等人,2013马里等人,2013)。C-NHEJ将导致在目标站点随机进行小的删除或插入.此外,在外源DNA供体存在的情况下,c-NHEJ可能导致DNA供体整合在目标位点,没有同源臂(同源性独立的靶向整合,HITI)(图1)。1)(Suzuki等人,2016)。然而,Hiti倾向于在DNA供体和靶位点之间的连接处诱发突变(Suzuki等人)。2016)。提供了单链寡核苷酸(SsODN),其同源性臂可以与DNA供体和靶位点配对,进一步提高了Hiti(Yoshimi等人)的靶向整合效率。2016)。HBR包括同源定向修复(Hdr)、微同源介导的末端连接(mmej或替代端连接)和单链退火(bennardo等人)。2008;Ceccaldi等人,2016;Chang等人,2017)。根据供体DNA类型,HDR可进一步分为单链模板修复(SSTR)和同源重组(HR)。1)(Sakuma和Yamamoto,2017;Richardson等人,2018;Yeh等人,2019)。HBR可以利用具有同源臂的外源DNA供体修复DSB,产生精确的目标基因,包括精确的缺失、精确的点突变、标签(或报告基因)整合和条件等位基因的产生(Yang等.)2013)。为防止编辑等位基因的重切,外源DNA供体应同时包含所需的序列改变和阻断沉默突变,这将防止gRNA-cas复合物切割所编辑的等位基因(paquet al.,2016;Kwart等人,2017)。值得注意的是,MMEJ和SSA也可以发生在目标位点两侧的两个同源序列之间,删除中间序列(沈等)。2018张和马特拉舍夫斯基,2019)。虽然最近开发的碱基编辑和初级编辑可以实现CRISPR-Cas核酸酶诱导HBR的某些功能(例如,精确的C到T转换、精确的A到G转换、精确的C到G转换、小的DNA片段删除和小DNA片段插入),但它们不能用于催化其他类型的碱基转换(如G-to-C转换)、插入大的DNA片段和产生条件等位基因(Komor等)。2016;Gaudelli等人,2017;Anzone等人,2019;Kurt等人,2020赵等人,2020 a)。然而,HBR在哺乳动物胚胎中的效率远远低于c-NHEJ,因此在编辑的胚胎中产生嵌合体.马赛克胚胎包含精确编辑的细胞、不完全编辑的细胞和未经编辑的细胞。对于小哺乳动物动物,如小鼠、大鼠和兔子,通过重复繁殖可以产生纯合子的编辑动物。然而,重复繁殖是大型哺乳动物动物模型生成的瓶颈,需要较长的时间才能达到性成熟(如猪和猴子)。此外,嵌合体和非故意编辑是阻碍人类胚胎基因组编辑疗法临床应用的主要技术问题(Zucaro等人)。2020)。提高CRISPR-CaS核酸酶诱导的HBR效率将减轻胚胎基因组编辑中的嵌合体(祖卡洛等人,2020)。总之,开发提高哺乳动物胚胎HBR效率的新方法具有重要意义。
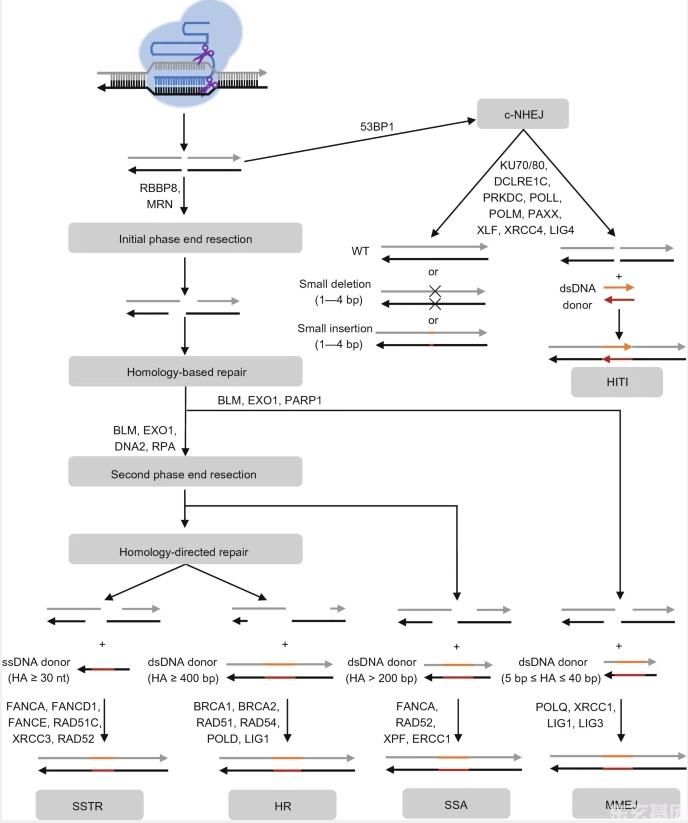
图1:参与CRISPR-CA介导哺乳动物细胞基因组编辑的DNA修复途径。
CRISPR-Cas核酸酶诱导的DNA DSBs通过c-NHEJ或基于同源性的修复(HBR)修复.53BP 1的加入抑制DSB部位的终末切除,通过c-NHEJ途径促进DSB的修复。在没有外源DNA供体的情况下,DSB的两端通过c-NHEJ通路与1-4 bp的小插入或缺失(Indel)精确或不精确地连接在一起。在无同源臂的双链DNA(DsDNA)供体存在的情况下,dsDNA供体可以通过c-NHEJ途径插入DSB位点。此外,DSB部位的两端可通过RBBP 8(或命名为CtIP)和MRN进行初始相端切除,产生短的3‘悬空。提供了一个具有同源臂的dna供体,3‘悬空将通过高保真同源修复途径进行DNA修复。利用短同源臂(5-40 bp)的dsDNA供体,可通过MMEJ途径修复DSB位点。此外,短的3‘悬垂可能会进行第二阶段的末端切除,产生较长的3’悬垂。在具有中同源性臂(>200 bp)的dsDNA供体存在下,DSB位点可通过SSA途径修复。利用长同源臂的dsDNA供体(≥4 0 0 bp),可通过HR途径修复DSB位点。在具有短同源臂(≥30 nt)的单链DNA供体存在下,可通过SSTR途径修复DSB位点。图中显示了每个通路中的一些主要蛋白质。箭头的方向代表5‘到3’的方向。删除黑十字。插入片段,彩色线条。C-NHEJ,经典的非同源端连接。希蒂,同源-独立的目标整合。MRN,Mre11-Rad50-NBS1复合体。哈,同源手臂。SSTR,单链模板修复。HR,同源重组。SSA,单链退火。微同源-介导的末端连接
关于通过控制DNA修复途径来改善HBR修复方面的最新进展,已经有了很好的综述(Liu等人,2008 a;Yeh等人,2019)。DNA供体是影响HBR效率的关键因素。在这篇综述中,我们的讨论仅限于通过设计适合哺乳动物胚胎基因组编辑的DNA供体来提高HBR,特别是在经常被调查的啮齿动物胚胎中。有几种类型的DNA供体,包括单链DNA(SsDNA)、双链质粒和线性双链DNA(DsDNA)。据信,小鼠和大型哺乳动物的胚胎基因组编辑结果相似。对这些数据的比较分析将为大型哺乳动物胚胎的胚胎基因编辑提供实用的指导(Ma等人,2007年a, 2018;Adikusuma等人,2018;Wilde等人,2018;Zucaro等人,2020).
利用单链dna供体进行同源修复
单链DNA(SsDNA)供体包括ssODN、长单链DNA(LssDNA)和单链腺相关病毒(AAV)基因组DNA.通常不超过200 NT的ssODN可以由商业公司合成。Lssdna是一个超过200 nt的ssdna,可以由离体转录和逆转录(IvTRT)(Miura等人,2015;Quadros等人,2017;Codner等人,2018;Li等人,2019),化学合成(Quadros等人,2017),用生物素标记的ssDNA的选择(Stahl等人,1988),以及dsdna的链特异性消化(Murgha等人,2014;Yoshimi等人,2016)。AAV是一种单链DNA病毒,基因组约为4.8kb.用双链AAV质粒载体、Rep-Cap质粒和辅助质粒转染HEK-293 T细胞可产生AAV。2020)。AAV感染后,单链AAV基因组DNA被释放到细胞中,并作为修复模板工作(Yoon等人.)2018;Chen等人,2019).
与双链dna(Dsdna)供体(如质粒和线性dsdna)相比,单链dna(Ssdna)供体的敲入效率(Ki)要高得多(miura等)。2015;Codner等人,2018)。由于ssDNA供体所使用的SSTR途径,ssDNA供体的同源性臂比质粒和线性dsDNA短得多,这使得DNA供体的构建更加方便和高通量。2017)。这两个特点使ssDNA成为理想的DNA供体。
使用ssODN的HBR
SsODN可用作修复模板,以生成精确的修改,如点突变、小插入或精确删除。为了达到较高的编辑效率,修饰后的cas核酸酶切位点之间的距离应尽可能小(≤30 bp)(Renaud等人)。2016;Quadros等人,2017)。通常,ssODN在5‘和3’端都包含一个≥30-nt同源性臂,其中较长的同源臂可以提高编辑效率(Renaud等人,2016)。然而,长同源臂的ssODN也表现出更严重的细胞毒性(Okamoto等人,2019).
以前使用ZFN和TALEN进行的基因组编辑研究已经证明,ssODN可以用作DNA供体,生成精确编辑的细胞和动物模型(Chen等人)。2011贝德尔等人,2012沈等人,2013)。将Cas9核酸酶与ssODN结合在一起,可以在人体细胞中有效地插入限制性酶识别位点(Cong等人,2013;Ran等人,2013)。将Cas9核酸酶与ssODN结合在一起,可以有效地纠正HBB和CYBB人类造血干和祖细胞(HSPC)的突变(DeWitt等人,2016;de Ravin等人,2017)。据报道,与ssODN的几个末端核苷酸结合的硫代磷酸酯(PS)可以通过保护ssODN不被降解而提高靶向插入效率(Papaioanou等人,2009),以前发现它可以提高CYBBHSPC(de Ravin等人)的突变2017)。但是,修理效率HBB磷酸硫代酸盐(PS)修饰不能改善突变(DeWitt等人,2016)。因此,硫代磷酸(PS)修饰能否提高靶向插入效率很可能取决于所使用的ssODN。除硫代磷酸酯(PS)修饰外,锁相核酸(LNA)修饰还可通过改善ssODN(Renaud等人)的稳定性,提高细胞的Ki效率。2016).
将ssODN与CRISPR-Cas核酸酶联合注入受精卵,可使小鼠、大鼠、兔、猪、羊、牛甚至人类胚胎中的小片段产生高效的Ki(表S1)。根据细胞数据,PS修饰的ssODN在小鼠和大鼠胚胎中的Ki效率也有所提高(表S1)(Renaud等人,2016)。然而,无论是PS修饰的ssODN还是LNA修饰的ssODN,都能提高大型哺乳动物和人类胚胎的Ki效率。
SsODN的一个限制因素是其长度有限(~200 nt),不可能获得较大的DNA片段Ki。虽然使用具有重叠区域的多个ssODN允许较大的片段Ki在C. 羊毛衫,重叠的ssODN在大鼠体内产生不完全的Ki(Paix等人,2016;Rmy等人,2017)。具有重叠区域的ssODN是否会在大型哺乳动物和人类的胚胎中产生更大的DNA片段Ki,目前尚不清楚。
虽然有些情况下,使用两个gRNAs和两个ssODN包含氧氟沙星序列来产生条件等位基因(这里称为双ssODN浮动方法)(如图所示)。2),使用ssODN生成条件等位基因效率低下(Yang等人)。2013;Pritchard等人,2017;Lanza等人,2018;Gurumurthy等人,2019)。在一项综合研究中,选择了56个基因,通过双ssODN浮动法(Gurumurthy等人.)产生条件等位基因。2019)。在生成的1,718只小鼠幼犬中,只有15只(0.87%)幼犬携带条件等位基因(Gurumurthy等人,2019)。一个主要的问题是,这两个lxp站点是集成的。反式,这意味着它们整合成两条不同的染色体,而不是同一条染色体(Lanza等人.)2018;Gurumurthy等人,2019)。然而,双ssODN浮动法的一个优点是,gRNA目标位点之间的距离(250~4,500 bp)并不影响条件等位基因产生的频率(Lanza等人)。2018)。这一优势有利于产生一个大的条件等位基因,使得在诱导过程中敲除非常大的DNA片段是可行的。
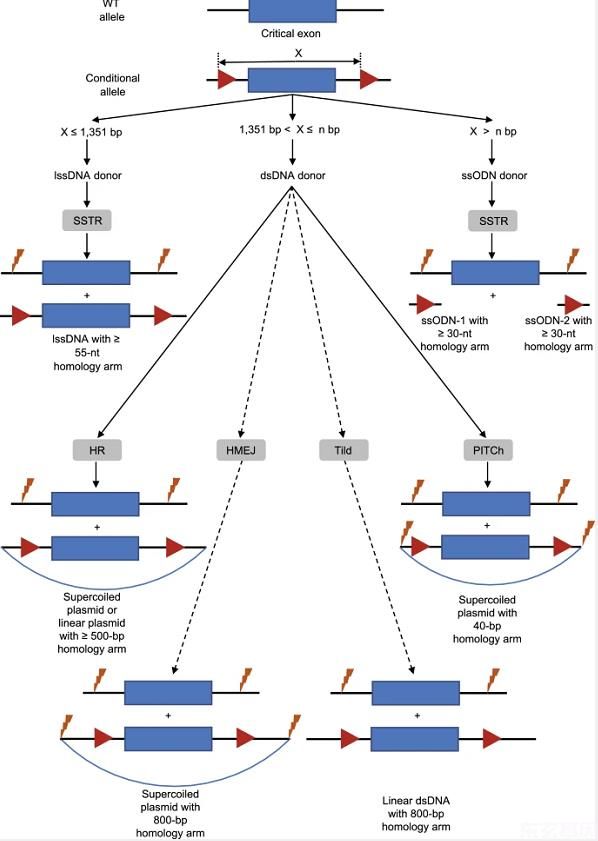
图2:哺乳动物胚胎的条件等位基因产生策略。
四种不同的策略,以实线为指示,根据两个gRNA切割位点之间的距离(定义为X)来产生条件等位基因。如果X≤1,351 bp,建议选择lssDNA供体。如果X>1,351 bp,建议采用dsDNA供体。虚线显示了两种可能的策略,即HMEJ和Tild,这两种策略仍有待在哺乳动物胚胎中测试。条件等位基因(NBP)的上限仍有待研究。使用ssODN生成条件等位基因效率低下,但可能用于产生非常大的条件等位基因(X>nBP)。内含子黑线。外显子蓝色盒子。GRNA切割位点,黄色闪电。氧氟沙星红三角。质粒骨架,蓝线。长单链DNA。SSTR,单链模板修复。双链DNA。HR,同源重组。HMEJ,同源-介导的末端连接。用线性化的dsDNA定向整合。目标染色体的精确整合。单链寡核苷酸 使用lssDNA的HBR
LssDNA的最大长度为5,000 nt,此后容易自发断裂(Lanza等人)2018)。与ssODN相比,lssDNA可以在小鼠和大鼠合子中产生更大的敲入片段和有效的条件等位基因。2和表S2)(Miura等人,2015;Yoshimi等人,2016)。LssDNA使用一个短的同源臂(通常在两端55-329 nt)与Ki外源DNA(表S2)。类似于ssODN,修饰与cas核酸酶切割位点之间的距离应尽可能小(Li等人,2019)。将两个gRNA和lssDNA结合在一起,两个gRNA切割位点(>30 bp)之间的预期突变点可以高效安装(表S2)(Codner等人)。2018)。利用lssDNA,Codner等。建立了一个点突变小鼠模型,其突变距离gRNA切割位点98 bp(codner等人.)2018)。然而,lssDNA的一个缺点是它比ssODN更有毒性。2019).
LssDNA已被用于细胞和动物胚胎中的大片段Ki,但在人类胚胎中未被利用(Miura等人,2015;Yoshimi等人,2016;Li等人,2019)。以lssDNA为供体,人HEK-293 T细胞GFP Ki效率高(5%~30%)。此外,较长的同源臂提高了HEK-293 T细胞的Ki效率,每端400~700 nt为最佳同源臂长度(Li等.)2019)。在小鼠受精卵中,Rolen等人。能够敲入1368 bp的DNA片段,在每一端都有一个90-nt同源臂的lssDNA(表S2)(Quadros等人),2017)。然而,目前尚不清楚是否有可能用短同源臂(55-144 nt)在动物合子中产生较大的DNA片段Ki(例如5,000-nt DNA片段)。为了提高大片段Ki的效率,长同源臂的lssDNA可能会有所帮助(Li等人)。2019)。PS修饰的lssDNA可能也能提高HBR的效率,但它尚未在细胞和哺乳动物胚胎中进行测试。
此外,lssDNA还可以用来产生一个条件等位基因。据我们所知,lssDNA已被成功地用于生成1,351 bp的条件等位基因(表S2)(Codner等人),2018)。然而,使用lssDNA产生更大的条件等位基因是否可行尚不清楚(Codner等人.)2018)。与ssODN相比,使用lssDNA生成条件等位基因的效率要高得多(表S1和S2)(Codner等人),2018;Gurumurthy等人,2019)。因为lssDNA包含两个氧氟沙星位点,所以它只需要一个重组事件,而两个ssODN浮动方法则需要在同一染色体上同时进行两次重组(Quadros等人)。2017;Codner等人,2018;Gurumurthy等人,2019)。因此,lssdna缓解了整合的挑战。反式并提高了产生条件等位基因的效率。然而,较长的同源臂(100 nt对60 nt)可能是提高效率的另一个重要因素(表S1和S2)(Quadros等人,2017).
然而,生产lssDNA比ssODN更昂贵和繁琐。化学合成lssDNA是昂贵的。该方法可以产生大量的≤2,000-NT lssDNA(>50μg)。2019)。然而,由于逆转录酶的加工能力差,所生成的lssDNA将被截断的lssDNA所污染(mohr等人,2013)。生物素标记的ssDNA的选择和dsDNA的链特异性消化需要通过PCR生成dsDNA,这可能会带来序列错误(Li等人)。2019)。虽然dsDNA的链特异性消化比ivTRT更方便,但产生的lssDNA量大约比ivTRT法低10倍(Murgha等人,2014;Yoshimi等人,2016;Li等人,2019)。此外,所有用于产生lssDNA的方法都可能导致DNA供体的意外突变。因此,有必要对所编辑的细胞和动物序列进行排序,以消除意外突变的影响。
使用AAV DNA的HBR
除了ssODN和lssDNA外,AAV的线性单链基因组DNA也被用作HBR模板。AAV是一种单链DNA病毒,可以用双链AAV质粒载体转染病毒包装细胞。
将ZFN(或TALEN)与AAV血清型6(AAV 6)供体结合,在HSPC和原代T细胞(Satheret al.)2015;Wang等人,2015)。后来证明,将CRISPR-Cas核酸酶与AAV 6供体载体结合,也能在HSPC中诱导有效的Ki(Dever等人,2016;Pavel-Dinu等人,2019)。有趣的是,AAV血清型1(AAV 1)供体载体在HEK-293 T细胞、U2OS细胞、人真皮成纤维细胞和大鼠C6细胞中联合CRISPR-Cas核酸酶诱导Ki效率高于常规质粒供体载体(Gaj等)。2017)。此外,AAV供体与CRISPR-Cas核酸酶一起被传送到肝脏,有效地纠正了遗传性酪氨酸血症小鼠模型和高氨血症小鼠模型中的突变(Yang等,2016;尹等人,2016;Krooss等人,2020)。将AAV供体和CRISPR-Cas核酸酶导入小鼠合子,可有效编辑基因组,包括大片段(771-3300 nt)的精确点突变和Ki(表S3)(Yoon等人)。2018;Chen等人,2019)。然而,使用AAV供体产生条件等位基因是否可行还有待于研究。
AAV供体的一个限制因素是包装能力有限(~4,600 nt),因此很难插入较大的基因编码序列(例如,DMD和F8)(Bak和Porteus,2017)。AAV供体载体的同源臂长一般为400-800nt.考虑到两翼400 nt同源性臂,插入DNA片段的长度应小于3 800 nt(Bak和Porteus),2017)。通过将两个AAV供体与CRISPR-Cas核酸酶结合,在HSPC和T细胞(Bak和Porteus)中插入5,700-nt DNA是可行的。2017)。然而,是否有可能利用AAV供体来编辑大型哺乳动物和人类胚胎中的目标基因仍有待检验(Chen等人)。2011;Gaj等人,2017)。首先,应筛选能感染大型哺乳动物和人合子的AAV血清型。然后,研究AAV供体向量的编辑效率。值得注意的是,使用AAV供体载体可能会给AAV感染带来新的安全隐患。
使用ssODN和lssDNA的HBR已被证明是通过SSTR途径发生的(Renaud等人,2016;Kanet al.,2017;Richardson等人,2018)。然而,使用AAV供体的HBR是否也通过SSTR途径发生还有待于阐明。
SSTR类似于HR的合成依赖链退火(SDSA)途径。2017;Yeh等人,2019)。而SSTR途径则利用了单链DNA供体(kan等人)。2017),HR通路利用双链DNA(DsDNA)供体。与人力资源不同,SSTR不依赖RAD 51(Bothmer等人,2017;Richardson等人,2018)。与以外源DNA供体为模板的模板DNA合成无关的MMEJ和SSA相反,SSTR和HR以外源DNA供体为模板,表现为链的侵入和随后的链延伸。2017)。然而,与SSTR有关的蛋白质仍未被探索.有人认为,一些与MMEJ、SSA和范可尼贫血通路有关的蛋白质可能参与了SSTR(Quadros等人)。2017;Richardson等人,2018)。为了鉴定与sstr通路有关的蛋白质,需要系统地丧失功能筛选(Richardson等人)。2018)。撞倒范卡或幻想1,研究发现,参与范可尼贫血通路的基因可以抑制AAV介导的小鼠心肌细胞Ki(Kohama等人)。2020),提示AAV介导的Ki是通过SSTR途径发生的。
值得注意的是,使用ssODN(或lssDNA)作为HBR模板的基因组编辑通常在ssODN(或lssDNA)修复模板(Renaud等人)的5‘端显示缺失突变。2016;GE和Hunter,2019)。5‘端缺失可能是由于细胞和胚胎中DNA合成不完全和MMEJ途径介导的缺失所致。3)(Renaud等人,2016;Yoshimi等人,2016)。5‘同源臂的延长改善了5’端缺失,提高了ssODN和lssDNA的Ki效率,表明长5‘同源臂的不对称ssODN和lssDNA优于对称ssODN(Renaud等人)。2016;Richardson等人,2016;Yoshimi等人,2016;Lanza等人,2018;Wang等人,2018)。然而,当部分Ki发生时,AAV供体的Ki是否也表现出类似ssODN和lssDNA的5‘缺失倾向仍有待研究(Renaud等人,2016;Yoshimi等人,2016迦南等人,2019)。5‘端缺失倾向是SSTR通路的一个重要特征。如果有5‘端缺失倾向,AAV供体的Ki可能通过SSTR途径发生。此外,延长5‘同源臂是否也将提高AAV供体的精确KI效率仍有待研究。
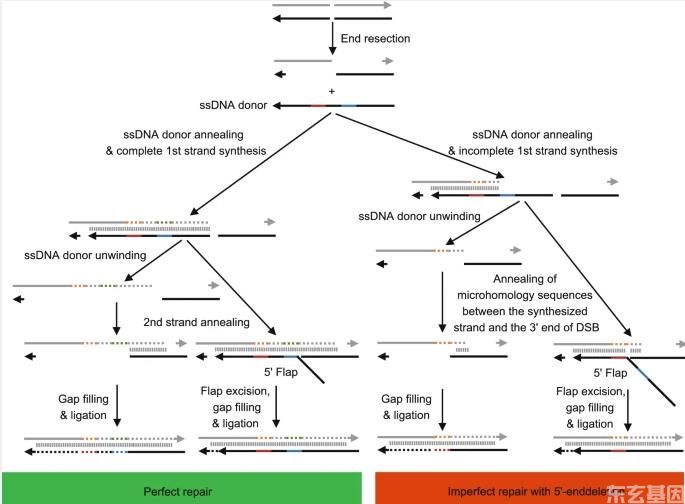
图3:通过SSTR途径实现完美修复和不完美修复的潜在机制。
由CRISPR-Cas核酸酶产生的DSB位点经过末端切除,产生3‘外展.在ssDNA供体存在的情况下,3‘端退火与ssDNA供体和素数DNA合成有关,导致第一链合成的完成或不完全。完成第一股合成复制3‘端编辑(红线)和5’端编辑(蓝线)。然而,不完全的第一链合成只复制3‘-末端编辑(红线)。在第1链合成后,ssDNA供体被解旋酶移除(或不去除)。新合成的第一链退火与DSB位点另一端的同源序列。如果摘除ssDNA供体,DSB将通过间隙填充和结扎修复。如果不去除ssDNA供体,退火过程产生一个5‘皮瓣的修复中间体,该修复中间体将通过皮瓣切除、间隙填充和结扎进一步修复,从而使ssDNA供体保留在靶部位。SSTR是否导致ssDNA供体在目标部位的保留仍在讨论中。在不完全的第一链合成过程中,新合成的第一链在DSB位点上搜索进行杂交的微同源序列,没有进行5‘-末端编辑,导致修复不完全。箭头的方向代表5‘到3’的方向。3‘-结束编辑,红线。5‘-结束编辑,蓝线。新合成的DNA虚线。SSTR,单链模板修复。
由于非靶链在Cas9切割后比靶链释放得早,ssODN供体介导的Cas9核酸酶诱导的HBR在某些位点表现出供体链的偏倚(Richardson等人)。2016;Lanza等人,2018)。结合Cas9核酸酶,ssODN与非靶链互补的HBR效率比ssODN高,而ssODN是对靶链的补充(Richardson等人.)2016;Lanza等人,2018)。相对于Cas9,Cas12a(例如AsCas12a和LbCas12a)表现出对ssODN互补于目标链的偏好(Wang等人,2018)。Cas12a切割DNA后,靶链的释放是否早于非靶链,有待进一步研究。此外,使用lssDNA和AAV供体载体的CRISPR-Cas核酸酶诱导的HBR是否也表现出这种链偏向还不清楚。
利用双链dna供体进行同源修复
DsDNA供体,包括质粒供体和线性dsDNA供体,适合插入大片段(>3.8kb),这是不可能使用单一的AAV载体(表S4)。使用dsDNA供体的HBR效率低于单链DNA,但允许使用CRISPR-Cas核酸酶(至多7.1kb)获得较大的Ki片段(表S4)(Menoret等人)。2015;Nakao等人,2016;Quadros等人,2017)。用dsDNA供体在3.1%(3/97)小鼠幼犬(表S4)中插入7.1 kb的DNA片段(Nakao等人),2016)。使用dsDNA供体的HBR通过三种不同的途径发生:同源重组(HR)、单链退火(SSA)和微同源介导的末端连接(MMEJ)。每个途径都需要不同的DNA供体载体构建策略。2).
HR利用外源dsDNA供体或内源性同源染色体作为修复模板(Yoshimi等人),2014)。HR的外源dsDNA供体既可以是超螺旋质粒,也可以是具有长同源臂的线性质粒。2和表S4)(迦南等人,2019)。与SSTR相比,HR需要更长的同源臂(>400 bp,通常为0.5~1kb)。2)。在人类细胞中,每一端至少需要一个400 bp的同源臂,才能有效诱导核酸酶诱导的HR,并发现同源臂的延长可以提高某些靶点的靶向插入效率(Hendel等人)。2014等人,2015).
在小鼠、大鼠、兔、猪和人类胚胎中,通过在受精卵中注射超螺旋或线性质粒,已经获得了成功的基因Ki或精确缺失(表S4)。线性质粒显示出比超螺旋质粒更高的Ki效率,但也导致了供体质粒的更高的随机整合(Menoret等人)。2015)。此外,条件等位基因也能在小鼠、大鼠和猪身上有效地产生(表S4)(Lee和Lloyd,2014)。据我们所知,该631-bp条件等位基因,由氧氟沙星浮动,是注射质粒供体和CRISPR-Cas核酸酶产生的最大等位基因(表S4)(Ma等人,2014)。理论上,可以产生更大的条件等位基因(最多7.1kb),但条件等位基因的上限(定义为n-BP)仍有待确定。
虽然HR允许精确整合大片段DNA,但HR的效率因细胞类型和物种而异。为了提高Ki,Yang等人的效率。张等人。开发了新的KI策略,这些策略可能通过SSA途径发生(姚等人,2017;Zhang等人,2017)。在此策略中,利用含有合成gRNA靶位点和两个800 bp同源臂的超螺旋质粒作为DNA供体。2)(姚等人,2017;Zhang等人,2017)。将超螺旋质粒线性化。体内并作为修复模板(称为同源介导的末端连接(HMEJ)策略,图1.2)(姚等人,2017;Zhang等人,2017).
SSA与MMEJ非常相似。首先,DSBs和dsDNA供体通过5‘端切除来显示长同源臂(>200 bp)(Liskay等人,1987),它们通过碱基配对彼此退火(如图所示。1)。然后,填补DSBs与dsDNA供体之间的空白,封闭断裂,导致外源DNA的插入(图1)。1)。涉及间隙填充和断裂密封的酶尚未被阐明(Yeh等人,2019).
后来的一项研究发现,这些超螺旋质粒可以被具有两个800 bp同源臂的线性dsDNA所取代(称为线性化dsDNA(Tild)策略的靶向整合)(图1)。2)(姚等人,2008 b)。这两种类型的DNA供体都能够在靶部位有效和精确地整合外源DNA(如图所示)。2)(姚等人,2008 b)。HMEJ和Tild策略在小鼠、猴子和人类胚胎中显示了有效的HBR(表S4)。2017;姚等人,2008 a, 2008 b)。然而,是否有可能使用HMEJ和Tild策略生成条件等位基因,虽然原则上是可行的(表S4)(姚等人,2017, 2008 a, 2008 b).
构建长同源臂质粒供体具有挑战性和耗时性,尤其是当靶区含有高GC含量或重复序列时。此外,由于同源性臂长,难以应用PCR和测序策略筛选出所编辑的细胞或动物。为了鉴定和确认所编辑的细胞或动物,应进行艰苦的Southern杂交试验。
精确整合到目标染色体(螺距)策略中,使用含有合成gRNA目标位点和两个微同源臂的超螺旋质粒作为修复模板(Nakade等人,2014)。构建螺距质粒供体比HR和SSA质粒供体方便得多,因为其同源性短(5-40 bp)(Nakade等人)。2014)。将超螺旋质粒和CRISPR-Cas核酸酶导入细胞后,超螺旋质粒和靶区均被切割。然后,微同源臂通过MMEJ途径辅助DNA的整合,由两个微同源臂围绕在一起(如图所示)。2)。首先,dsb和dsdna供体通过5‘端切除来显示一个短的同源臂,通过碱基配对进行退火(如图所示)。1)。然后,dna聚合酶θ结合退火后的产物,通过模板合成填补dsb和dsdna供体之间的空白。1)。最后,DNA断裂被DNA连接酶I或DNA连接酶III所封闭,从而导致外源DNA的靶向插入。1)(Yeh等人,2019).
与HR不同,HR在晚S/G期间是活跃的2各阶段,MMEJ在G期间是活跃的1/早期S阶段。据报道,在家蚕胚胎和斑马鱼胚胎中成功地通过沥青定向整合,其人力资源效率很低(Nakade等人,2014)。利用基音策略,在12%(3/25)小鼠受精卵(表S4)(Aida等人)中成功地插入了一个5 kb的DNA片段。2016)。某些mmej相关基因的异位表达(例如,Exo 1, LIG 3, PARP 1, NBS 1, FEN 1, BLM,和MRE11A)提高MMEJ在人类细胞中的效率,而HR相关基因的异位表达(例如,RAD 51)和与ssa相关的基因(例如,RAD 52)被抑制的MMEJ(Aida等人,2016)。外切酶1(EXO 1)是一种5‘-3’的外切酶,参与DSB的终切。与EXO 1核酸酶共注入,小鼠受精卵中沥青的Ki效率提高了约3倍(表S4)(Aida等人),2015, 2016;Hisano等人,2015)。此外,通过基音策略(表S4)(Aida等人),有效地生成了条件敲除小鼠模型(33.3%)。2016)。因此,基音策略既能有效地生成大片段Ki动物模型,又能方便地识别大片段Ki动物模型。
虽然HBR效率因部位不同而不同,但上述四种策略(HR、HMEJ、Tild和沥青)在哺乳动物胚胎中表现出不同的HBR效率。与使用超螺旋质粒的常规HR相比,Tild在人类胚胎中的HBR效率提高了6.4倍(姚等)。2008 b)。比较沥青和HMEJ的HBR效率,发现HMEJ在三个靶点的效率(1.9~3.7倍)远高于沥青(1.9-3.7倍)。Actb, DBH,和SOX 2)小鼠胚胎(表S4)(姚等人,2017)。此外,在三个位点,Tild(与线性化dsDNA的靶向整合)的HBR效率(1.6~3.3倍)高于HMEJ(同源介导的末端连接)。Cdx 2, Actb,和SP8)小鼠胚胎(表S4)(姚等人,2008 b)。因此,哺乳动物胚胎的HBR效率顺序为:TLD>HMEJ>螺距≥HR。根据目前的数据,Tild和HMEJ策略可能是大型哺乳动物和人类胚胎中大片段DNA敲入的首选方法。
基于同源性的DNA供体的增强修复
由于HBR需要在目标地点有一个DNA供体,许多努力都致力于增加目标位点上的DNA供体的浓度,以提高HBR。最近,已经开发了几种方法,通过将DNA供体与gRNA-Cas9复合物(图1)绑定到目标位点来招募DNA供体。4).
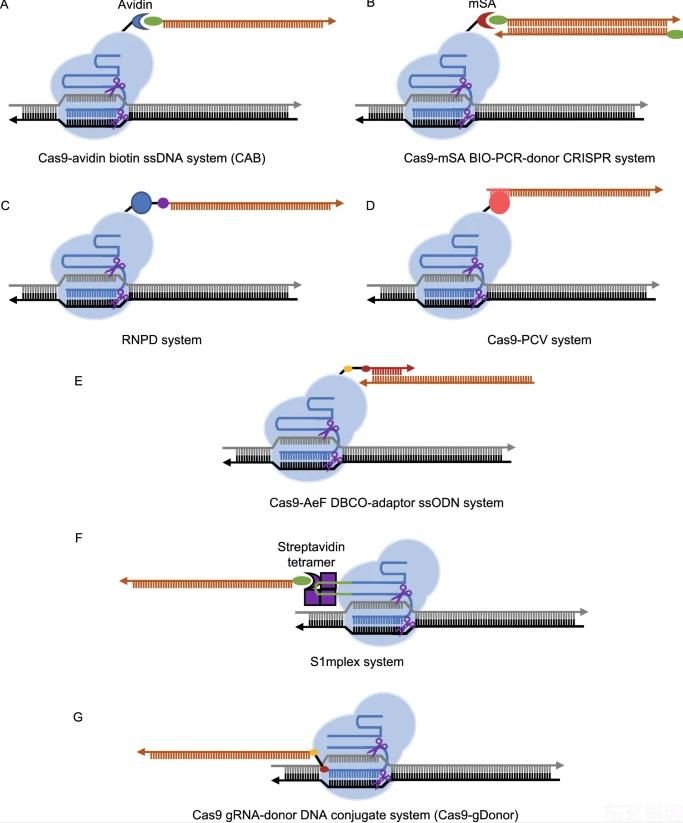
图4:向目标站点招募供体DNA的不同方法。
(A)Cas9-avidin生物素ssDNA(CAB)系统。生物素绿色椭圆形。(B)CAS9-MSA生物PCR-供体CRISPR系统。单聚链霉亲和素。(C)核糖核酸蛋白DNA(RNPD)系统。短肽蓝圈。奥6-苄基鸟嘌呤(BG),紫色圆。SNAP肽与O的共价键6-苄基鸟嘌呤(BG),黑线。(D)Cas9-PCV系统。PCV为猪圆环病毒2 Rep蛋白,呈粉红色圆形。PCV识别序列粉红色线。(E)Cas9-AEF DBCO-适配器ssODN系统。AEF,非正则氨基酸4-(2-叠氮乙氧基)-1-苯丙氨酸。AEF叠氮组,金卵圆形。DBCO红色椭圆形。适配器红线。(F)S1复合系统。嵌合RNA由gRNA和S1M适配体组成,通过与链霉亲和素四聚体(紫色盒)相互作用,使生物素标记的ssDNA供体进入靶区。S1M适体,绿线。(G)引导RNA供体DNA共轭(GDonor)系统。叠氮组,金色椭圆形。DBCO红色椭圆形。GRNA,蓝线。DNA供体橙系。
Cas9-avidin生物素ssDNA(CAB)系统利用卡氏9-亲和素融合蛋白和在5‘端标记生物素的ssDNA。4(Ma等人,2007年b)。亲和素和生物素之间的相互作用使一个DNA供体进入靶点,从而提高了人体细胞的HBR效率(2-5倍)(Ma等人),2007年b)。此外,CAB体系使小鼠胚胎的HBR效率比传统的CRISPR-Cas9核酸酶提高了3倍。2007年b)。建立了基于单链霉亲和素(MSA)与生物素相互作用的类似体系。不同于CAB系统,Cas9-MSA生物PCR供体CRISPR系统使用生物素标记的dsDNA供体作为修复模板。4B)(顾等人,2018;Roche等人,2018)。采用5‘-生物素修饰引物进行PCR扩增,获得生物素标记的dsDNA供体.Cas9-MSA生物PCR供体CRISPR系统提高了人类细胞和2细胞小鼠胚胎的HBR效率(1.6~3.8倍)。2018;Roche等人,2018).
除了亲和素-生物素非共价相互作用外,其他蛋白质-底物共价相互作用也被用来招募DNA供体.核糖核酸dna(Rnpd)系统由gRNA、Cas9-snap融合蛋白和O组成。6-苄基鸟嘌呤(BG)-标记为ssODN(Savic等人,2018)。Snap肽能与O结合6-苄基鸟嘌呤(BG)-共价标记ssODN,将ssODN招募到目标位点。RNPD系统提高了人HEK-293 T细胞(7-24倍)、K 562细胞(17倍)和小鼠胚胎干细胞(2-6倍)(Savic等人)的HBR效率。2018)。有趣的是,核内ssODN浓度的增加足以提高HBR效率(Savic等人,2018)。同样,Cas9-PCV系统基于猪圆环病毒2(PCV)Rep蛋白与其识别DNA序列的共价相互作用(Aird等人)。2018)。带有PCV识别序列的ssODN被gRNA-Cas9-PCV复合物招募到目标位点,从而提高了HBR效率(Aird等人,2018).
最近,发展了一种基于非正则氨基酸(NCAA)修饰的Cas9的方法。2020)。在此Cas9-AEF DBCO-适配器ssODN系统中,用一种名为4-(2-叠氮乙氧基)-l-苯丙氨酸(AEF)的NCAA取代了Cas9的G 1367残基。纯化的Cas9-AEF蛋白与gRNA、DBCO修饰的ssDNA适配器和ssODN供体共同孵育.AEF的叠氮基团与二苄基环辛烷(DBCO)反应,将DBCO修饰的ssDNA适配器连接到CaS 9上。连接的ssDNA适配器然后通过碱基配对来招募ssODN供体,将ssODN与gRNA-Cas9复合物结合。将Cas9-AEF DBCO-适配器ssODN系统导入人体细胞,可使HBR效率提高10倍(凌等,2020)。此外,在小鼠胚胎中注射Cas9-AEF DBCO-适配器ssODN系统也使HBR效率提高了2.3倍(ling等人,2020).
和Cas9蛋白一样,gRNA也可以用来招募DNA供体。S1M适配体是一种能够结合链霉亲和素四聚体的RNA片段,安装在gRNA的第一个茎环中。生物素标记的ssDNA供体与链霉亲和素四聚体相互作用,后者被S1M适配体招募到gRNA-Cas9复合物中。4F)(Carlson-Stevermer等人,2017)。将这种S1mplex系统导入人体细胞后,HBR/Indel频率比增强(2.7-18.4倍);然而,这导致绝对HBR效率下降(Carlson-Stevermer等人,2017)。此外,供体DNA可以直接与引导RNA结合。在Cas9gRNA-供体DNA共轭体系中,供体DNA与crRNA-tracrRNA二聚体中的rRNA 5‘端结合,形成gRNA-供体DNA共轭物(GDonor)(Lee等.)2017)。纯化的Cas9蛋白能与gDonor结合离体(Lee等人,2017)(图1.4g)。将这种组装的复合物导入人体细胞后,HBR效率明显提高(Lee等人)。2017).
在上述七个系统中,只有三个系统(CAB系统、Cas9-MSA生物PCR-供体CRISPR系统和Cas9-AEF DBCO-适配器ssODN系统)在小鼠胚胎中被证明是有效的。在相同的情况下,比较所有七种系统在哺乳动物胚胎中的效率是很有趣的。这些结果将有助于我们确定最有效和安全的哺乳动物胚胎基因组编辑系统。
利用内源性同源DNA进行同源修复
除外源DNA供体外,内源性同源DNA可作为小鼠和人三原核合子的HBR模板(Wu等人)。2013梁等人,2015)。本研究小组发现,人类三原核合子更倾向于内源性同源DNA(HBD)在编辑过程中发送给ssODN供体。HBB人三原核合子中的基因2015)。这个HBD用作修复模板的基因可能来自父系或母系染色体(梁等人)。2015)。稍后,Mitalipov等人。发现人类二倍体受精卵更愿意使用野生型母染色体而不是ssODN作为修复模板(Ma等人)。2007年a)。然而,由于CRISPR-Cas核酸酶对靶DNA的快速切割以及单个细胞胚胎中父系染色体与母系染色体之间的空间距离,母体染色体能否作为修复模板仍是一个争议的话题(Ma等人)。2007年a, 2018;Adikusuma等人,2018;Egli等人,2018;Reichmann等人,2018)。对Mitalipov数据的另一种解释是,由于大的DNA片段缺失、DNA片段复制导致节段父本染色体丢失、完全父本染色体丢失或易位,父本等位基因没有被扩增(Adikusuma等)。2018;Egli等人,2018;Alanis-Lobato等人,2020;Zucaro等人,2020)。最近,Egli等人。发现当父系和母系基因组位于同一核时,利用母体染色体的模板修复可能会发生在人类两种细胞的胚胎中。然而,其效率相对较低(~7%)(祖卡洛等人),2020)。在单细胞阶段,由于雌雄原核分离,母染色体模板修复没有发生(祖克罗等人,2020)。此外,他们还发现,即使是单个CRISPR-卡斯核酸酶诱导的切割,也可能导致靶染色体的频繁丢失,破坏人类早期胚胎中整个染色体的稳定性,从而导致利用PCR进行靶向DNA扩增失败(祖卡洛等人)。2020)。值得注意的是,这些发现还强调了使用CRISPR-Cas核酸酶编辑人类胚胎基因组时出现大片段缺失和非整倍体的风险(祖卡洛等人)。2020)。在利用CRISPR-Cas核酸酶编辑人类胚胎基因组的同时,还需要进一步的机制和方法学研究来消除大片段缺失和非整倍体。
使用内源性同源DNA模板的HBR可以降低外源DNA供体产生预期基因组修饰的效率。然而,它也允许通过使用内源性同源DNA模板进行模板修复来纠正基因突变(梁等人)。2015)。因此,根据基因组编辑的目的,使用内源性同源序列的HBR可能是有益的,也可能是有害的。
Rna模板dna修复:初级编辑
除了DNA,RNA还可以作为修复模板。最近,刘等人。开发了由初级编辑器(PE)蛋白和主要编辑指南RNA(PegRNA)组成的初级编辑器,以编辑基因组而不诱导DNA DSB(Anzone等人,2019)。Pe蛋白由Cas9n-H840A和M-MLV逆转录酶变异体(M-MLVD200N+L603W+T330P+T306K+W313F)组成。PgRNA由四个部分组成:一个引导序列、一个gRNA主干、一个反转录(RT)模板和一个引物结合位点(PBS)。在pgRNA的引导下,PE:PEgRNA复合物与靶区的靶链结合,导致非靶链的位移。然后,PE蛋白的Cas9n-H840A RuvC核酸酶结构域切割非靶链,在非靶链上暴露一个3‘-高绿豆酰基。断裂和移位的非靶链将通过碱基配对与pbs杂交,该链上的3‘-羟基将被MMLV逆转录酶结构域用于启动反转录。因此,在pgRNA的RT模板中编码的编辑将被复制到目标站点中。新合成的DNA将取代目标部位的野生型序列,形成一个5‘-皮瓣,由DNA修复酶切割和封闭。
基于这一策略,初级编辑器已经被用于在HEK-293 T细胞中产生精确的点突变、小缺失(≤80 bp)和插入(≤40 bp)。2019)。然而,由于未知的原因,初级编辑程序在人类iPSCs和小鼠胚胎中的效率很低(Liu等人)。2020;Surun等人,2020)。因此,需要进一步的研究,以提高原始编辑在哺乳动物胚胎中的效率。
结论和展望
SsDNA和dsDNA供体各有优缺点。例如,ssDNA可能在同源臂(ssODN和lssDNA)、氧氟沙星位点(ssODN和lssDNA)和氧氟沙星浮动区(ssODN和lssDNA)(Lanza等人)中引入序列错误。2018)。SsDNA可通过电穿孔法(如合子电穿孔和iGONAD)产生Ki小鼠,而利用合子电穿孔提供的dsDNA供体成功地进行基因组编辑尚未见报道。到目前为止,dsDNA捐献者已通过显微注射进入受精卵(Rmy等人,2017;Miyasaka等人,2018大冢等人,2018)。因此,将ssDNA供体导入受精卵比将dsDNA供体运送更为方便。此外,dsdna供体通常会导致更高的细胞毒性和更多的非目标整合(Chen等人)。2011)。为指导用于哺乳动物胚胎基因组编辑的HBR dna供体设计,dna供体设计和编辑结果在表中作了总结。1。此外,图中提供了一个决策树,说明了DNA供体设计的主要考虑因素。
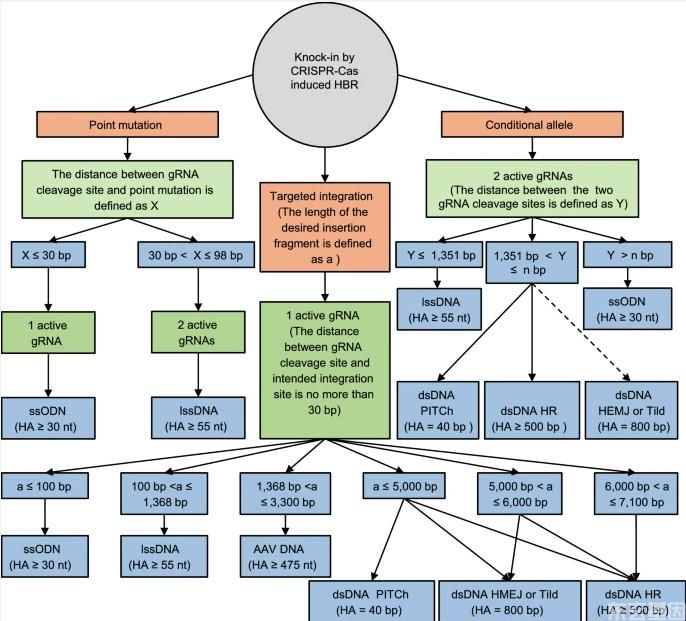
图5:选择HBR施主向量的决策树。
HBR供体载体的设计应考虑几个关键因素,包括所需的敲入型(点突变、靶向整合和条件等位基因)、gRNA切割位点与所需编辑位点(X)之间的距离、所需插入片段的长度(A)以及两个gRNA切割位点之间的距离(Y)。对于点突变,如果X≤30 bp,建议使用ssODN供体。然而,如果30<X≤98 bp,建议使用lssDNA供体。对于靶向整合,如果X≤30 bp,建议使用一个有效的gRNA策略。如果使用≤100 bp,建议使用ssODN。如果所需插入片段的长度增加,则建议采用其他策略,如下图所示。对于靶向整合,如果X>30 bp,则应采用类似于条件等位基因生成的策略。对于条件等位基因的产生,首先要识别两个活性的gRNAs。如果两种活性gRNAs(Y)之间的距离不超过1 351 bp,则推荐使用lssDNA。利用dsDNA产生的条件等位基因(NBP)的上限有待进一步研究。如果1,351<Y≤n bp,建议使用dsDNA供体(例如,Pch和HR)。虽然HEMJ和Tild还没有被用于在哺乳动物胚胎中产生条件等位基因,但从理论上讲,HEMJ和Tild可以用来产生条件等位基因。虽然使用ssODN生成条件等位基因的效率很低,但它可以用来产生非常大的条件等位基因(Y>nBP)。固体线表明在哺乳动物胚胎中已经证明的策略。 最近,Iyer等人。用重叠感染法产生长圆形单链dna(Cssdna)E. 大肠杆菌含VCSM 13辅助噬菌体的噬菌体(Iyer等人,2019)。辅助噬菌体提供的dna复制机制可以识别噬菌体的F1来源,产生具有环状单链DNA的噬菌体。然后收集这些噬菌体来纯化cssDNA。长cssDNA供体在人HEK-293 T细胞和K 562细胞中被用作HBR模板。与线性ssDNA供体相比,长cssDNA具有更高的HBR效率(Iyer等人,2019)。探讨长cssDNA是否也能提高哺乳动物胚胎的HBR,为哺乳动物胚胎基因组的编辑提供了新的途径。
除了DNA供体外,CRISPR-Cas核酸酶的切割效率是影响HBR效率的主要因素(Lanza等人,2018)。因此,在设计DNA供体之前,应将高活性的gRNAs与CRISPR-Cas核酸酶一起传递到细胞或胚胎中,从而筛选出高活性的gRNAs。此外,改变CRISPR-Cas核酸酶的组成也可以提高其切割效率.CtRNP(crRNA+tracrRNA+Cas9蛋白)复合物比Cas9-mRNA/gRNA混合物和gRNP(gRNA+Cas9蛋白)复合物(Quadros等)具有更高的Ki效率。2017).
此外,控制CRISPR-Cas核酸酶和DNA供体传递的时间也有助于提高HBR效率和减少嵌合体(Ma等人,2007年a;Guu等人,2018)。据报道,在小鼠双细胞期微量注射,Ki效率比单细胞期提高了10倍以上。2018)。然而,是否将CRISPR-cas核酸酶和dna供体注射到S/G中?2相(PN3-PN5)合子比G1期(PN0-PN2)合子的编辑效率更高,仍有待确定(Wossidlo等人,2011).
此外,gRNA的特异性也是一个重要的考虑因素。卡氏9镍酶(Cas9n)只切割一条DNA双螺旋,具有较高的特异性,但由于其低效率而不常用于Ki(Lee和Lloyd),2014;Cornu等人,2017;Kanet al.,2017)。值得注意的是,ssdna和dsdna供体都能够随机整合到基因组中,特别是在非目标位点(Quadros等人)。2017;Lanza等人,2018;Li等人,2019)。因此,检测F1代动物DNA供体的随机整合事件是非常重要的。
除了CRISPR-Cas核酸酶介导的HBR外,碱基编辑器还被用于在哺乳动物和人类胚胎中高效地生成点突变而不诱导DNA DSB(Kim等人,2007年b梁等人,2017, 2018;;Liu等人,2008 b, 2008 c;Ryu等人,2018;Yang等人,2018;Anzone等人,2020)。胞苷碱基编辑器(CBE)由胞苷脱氨酶、Cas9n-D10A和尿嘧啶DNA糖基化酶抑制剂(UGI)融合蛋白组成,在gRNA(Komor等)的指导下,能催化活性窗口的C-T转换。2016),而由胞苷脱氨酶和Cas9n-D10A融合蛋白组成的C-to-G碱基编辑器(CGBE)则能催化C到G在活性窗口中的转化(Kurt等人,2020赵等人,2020 b)。类似地,由腺嘌呤脱氨酶和Cas9n-D10A融合蛋白组成的腺嘌呤碱基编辑器(ABE)在活动窗口催化A到G的转换(Gaudelli等人,2017)。当使用碱基编辑编辑哺乳动物和人类胚胎的基因组时,必须注意非目标dna和rna突变(kim等人)。2007年a, 2007年c, 2019;Grunewald等人,2019a;Jin等人,2019梁和黄,2019梁等人,2019a, 2019 b;;周等人,2019;Zuo等人,2019)。高保真度基础编辑器变体,具有较低的非目标效果,应使用(梁等人.)2017;Grunewald等人,2019 b梁和黄,2019梁等人,2019a;Rees等人,2019;;周等人,2019;Doman等人,2020;Yu等人,2020;Zuo等人,2020)。Anzone等人最近的一篇评论。是为基因组编辑选择合适的基础编辑器的极好指南(Anzone等人.)2020).
此外,crispr相关转座酶靶向插入大的dna片段的报道已经在E. 大肠杆菌(Klompe等人,2019;Strecker等人,2019)。然而,这些CRISPR相关转座酶是否会导致真核细胞的靶向插入还有待于阐明。因此,深入研究CRISPR相关转座酶可使大片段DNA定向插入真核细胞和哺乳动物胚胎。
基因组编辑工具的出现使经基因组编辑的哺乳动物得以产生,这不仅有助于提高我们对生命和疾病基础生物学的认识,而且还将促进畜牧业的进步。这些工具可用于修复疾病突变。原地具有治疗不治之症的潜力,促进了未来精密医学的发展。