

癫痫基因的致病变异会导致临床严重程度的变化。表型异质性的一个来源是影响主要致病变异体表达能力的修饰基因。小鼠癫痫模型在不同的遗传背景下也表现出不同程度的临床严重程度。小鼠杂合子缺失SCN1A (SCN1A+/−)模型德拉维综合征,一种严重的癫痫,最常见的原因是SCN1A单倍体功能不全。SCN1A+/−小鼠重述德雷韦综合征的特征,包括自发性癫痫、猝死和认知/行为缺陷。SCN1A+/−129S6/SvEvTac(129)株小鼠寿命正常,无自发性癫痫发作。与之形成对照的是,与C57BL/6J(B6)混合使用会导致癫痫和早产儿死亡。我们以前绘制了Draview生存修饰符基因座(Dsm1-DSM5)负责与菌株有关的差异的生存。GABRA 2,编码GABAAα2亚基,被提名为候选修饰符Dsm1。GABA的直接测量A与129个相比,B6小鼠海马突触中含有α2的受体丰度较低。我们还发现了一种b6特异性的单核苷酸缺失。GABRA 2使mRNA和蛋白质降低近50%。修复此缺失已恢复正常水平GABRA 2表达.在本研究中,我们使用修复后的B6小鼠。GABRA 2等位基因评估GABRA 2作为一种严重程度的基因修饰剂SCN1A+/−老鼠。GABRA 2修复恢复转录和蛋白表达,增加含α2的GABA丰度A大鼠海马突触受体与癫痫表型的拯救SCN1A+/−老鼠。这些发现证实了GABRA 2作为DRAVET综合征的遗传修饰剂,支持增强α的功能2-含GABAA受体作为Draview综合征的治疗策略。
导言
德雷韦综合征是一种严重的婴儿发育性和癫痫性脑病(Dee),至少80%的病例是由新发性变体引起的。SCN1A(Claes等人)2001)。Draview综合征患者表现出多种癫痫类型,这些类型通常不符合标准治疗方法,癫痫突发死亡(SUDEP)、认知和行为缺陷以及运动系统功能障碍的风险较高(DeLange等)。2019德拉维2011)。表型异质性在单基因癫痫综合征中很常见,临床表现多种多样,从良性发作到难治性癫痫和增加SUDEP风险(Cetica等)。2017;Escayg等人。2000;Gardella等人。2016戈德伯格-斯特恩等人。2014;HelBig和Tayoun2016;M ller等人。2015;Nakamura等人。2013、Patino等人。2009;Syrbe等人。2016;Weckhuysen等人。2012)。影响外显率和表达性的修饰基因可能是导致这种变异的因素,可能是癫痫有效的治疗靶点。
SCN1A单倍体功能不全是Draview综合征的主要原因;因此,小鼠出现杂合子缺失。SCN1A发展成Draview综合征模型(Miller等人)。2014;Ogiwara等人。2007;Yu等人。2006). SCN1A+/−小鼠概括了Draview综合征的几个核心特征,包括自发性癫痫发作,猝死风险升高,以及神经行为和认知缺陷(han等人)。2012;Hawkins等人。2007年a;Ito等人。2013;Kalume等人。2013;Miller等人。2014;Ogiwara等人。2013)。这些显性表型在C57BL/6J(B6)遗传背景上具有很强的穿透性,但当突变发生在129株近交系背景上时则不存在。2018;Miller等人。2014;Ogiwara等人。2007;Yu等人。2006)。虽然129。SCN1A+/−小鼠没有表现出自发性癫痫,他们对高温或化学性惊厥所致急性癫痫的易感性增高(Mistry等人)。2014;Rubinstein等人。2015)。利用该菌株的差异,我们先前进行了遗传图谱,并确定了几种Draview生存调节剂(DSM)与应变相关的猝死发生率差异的基因座(Dsm1-5)(Miller等人。2014). GABRA 2,编码GABA的α2亚基。A受体,是世界上排名最高的候选基因。Dsm1轨迹(Hawkins等人)2016;Miller等人。2014)。显著差异GABRA 2以前曾报道过几种近交系小鼠的表达(Korostynski等人)。2006;Mulligan等人。2012;Yeo等人。2016;Yu等人。2020)。进一步调查GABRA 2表达定量性状位点(EQTL)鉴定了1976年后仅存在于B6基因组中的一个剪接受体位点上的单核苷酸新缺失(Mulligan等人)。2019, 2012)。这种b6特定的变体导致全球减少GABRA 2与较老的B6株和其他16种常见和野生来源的近交系小鼠相比,大脑中转录和蛋白的表达(Mulligan等人)。2019)。修复GABRA 2内含子的表达完全恢复到其他自交系的水平(Mulligan等人)。2019)。B6小鼠修复GABRA 2等位基因(Mulligan等人)2019)提供了一个理想的平台来测试GABRA 2在……里面SCN1A+/−德雷维老鼠。
在目前的研究中,我们试图确定这种单核苷酸缺失是否导致了与Dsm15号染色体上的位点。我们使用带修复的B6小鼠(编辑)GABRA 2等位基因(编辑/B6小鼠)与129只小鼠杂交。SCN1A+/−目的:确定小鼠对Draview表型的影响。我们用这种单核苷酸修复观察了癫痫发作、存活和神经元表型的拯救,并进行了验证。GABRA 2作为癫痫修饰基因。
方法
道德声明
所有动物护理和实验程序均由西北大学动物护理和使用委员会根据美国国立卫生研究院“实验室动物护理和使用指南”批准。在规划实验时考虑了“动物研究:体内实验报告”和“巴塞尔声明”(包括3R概念)中概述的原则。
小鼠
使用CRISPR/Cas9编辑将单个内含子核苷酸插入到GABRA 2C57BL/6J(B6)菌株B6。GABRA 2Em1geh,如前所述(Mulligan等人。2019)。杂合子编辑GABRA 2小鼠(Edited/B6)继续回交C57BL/6J(Jackson实验室,#000664,bar港,ME)。
SCn1aTm1kea第一个编码外显子缺失的小鼠,是通过在TL1 ES细胞中进行同源重组而产生的(Miller等人)。2014)。这个系是通过不断回交杂合子来维持的。SCN1A+/−)129S6/SvEvTac近交系小鼠(129,Taconic,#129 SVE,Rensselaer,NY)。
产生双突变小鼠,杂合子编辑/B6GABRA 2小鼠杂交到129只。SCN1A+/−老鼠。由此产生的后代具有完整的F1基因组背景,B6/129或Eded/129等位基因位于GABRA 2和WT(+/+)或杂合缺失(+/−)SCN1A.
小鼠被维持在一个特殊的无病原体(SPF)屏障设施,14小时的光/10小时的黑暗周期,并获得食物和水和锂。实验以雌性和雄性小鼠为实验对象。
基因分型
用Gentra Puregene小鼠尾巴试剂盒从P14尾活组织切片中分离DNA,根据制造商的指示(前根,巴伦西亚,CA)。为GABRA 2用BamHI-HF(R 3136,New England Biolabs,Ipswich,MA)在37°C下消化约250 ng DNA,然后用无核酸酶水稀释1:1,然后用探针(No DUTP)(Bio-Rad,Hercules,CA)和一种定制的TaqMan SNP基因分型法(Life Technologies,CA)检测插入(Primer 1:5‘-GCTTCTTTCCATTTCATTGGAAA;
引物2:5’-GCTTATATATATACTCTTATATATACTCTCTCTTATATACTCTTCTATATATACTCTTCTATATATATATATATCATCTATATATATATATCARAA;
引物2:5‘-GTATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATATA
TATATATATATATATATATATATATATATATATATATATATATATAB6等位基因探针2:5‘-FAM-CTATTTACTCCTAAATAT-NFQ)。在QX 200液滴发生器(Bio-Rad)中将反应分成液滴.PCR条件为:95℃×10 min,95°C×30 s,60°C×1 min(斜坡速率2°C/s)44次,最终灭活步骤98°C,5 min。在扩增后,用QX 200液滴阅读器对液滴进行了分析,用全塔Soft v1.6.6软件(Bio-Rad)进行了分析。为SCN1A,采用多重PCR方法检测基因型,如上文所述(Miller等人)。2014).
成绩单分析
用以下方法提取小鼠全脑总RNAGABRA 2等位基因:B6/B6、Eded/B6、B6/129、Edited/129和129/129。总RNA用TRIzol试剂根据制造商的指示进行分离。利用寡核苷酸(DT)引物和上标IV逆转录酶(RT),根据生产厂家的指令(LifeTechnologies),从2g RNA中合成第一链cDNA。第一链cDNA样品稀释1:10,以5μ1为模板.采用ddPCR技术对小鼠进行探针(无dUTP)(Bio-Rad)和Taqman基因表达检测(生命技术)定量ddPCR。GABRA 2(fam-mgb-mm00433435_m1)和TBP(VIC-MGB-Mm00446971_M1)作为标准化标准。将反应分为QX 200液滴发生器(Bio-Rad).热循环条件和分析被描述为基因分型。两种检测方法在非RT和模板对照中都缺乏可检测的信号.相对转录水平表示为GABRA 2到TBP浓度,每组有6-13个生物复制。小鼠年龄从P23到P41不等。各组间的统计比较采用方差分析(ANOVA)和邓尼特(Dunnett)后比较(图垫棱镜,加利福尼亚州圣地亚哥)。数据为平均值±扫描电镜。
免疫印迹
用以下方法从小鼠中分离出全脑P3膜蛋白组分GABRA 2等位基因:B6/B6,Eded/B6,B6/129,Edited/129和129/129小鼠1984)。在7.5%SDS-PAGE凝胶上分离出50μg/L的膜组分,并将其转移到硝化纤维素中。兔多克隆探针GABRA 2抗体(822-GA2CL,光敏液;RRID:AB_2492101;1:1000)和小鼠单克隆抗死蛋白/GRP 75抗体(NeuroMab N52A/42;RRID:2120479;1μg/mL),作为正常对照。用抗兔Alexa Fluor 790和抗小鼠680抗体(Jackson免疫研究,1:20,000)在奥德赛成像系统(Li-COR)上检测信号。用ImageStudio软件(Li-cor)密度法测定相对蛋白水平,并将其表达为GABRA 2GRP 75,每组5~6个生物复制。小鼠年龄从P21到P42不等。各组间的统计比较采用单因素方差分析(ANOVA)和邓尼特(Dunnett)的事后比较(GraphPad Prism)。数据为平均值±扫描电镜。
电生理学
用B6/B6小鼠制备了22~31日龄雄性和雌性小鼠急性水平海马脑片(350 M)。n=3只老鼠)或B6/编辑(n=3只小鼠)GABRA 2。本实验用的所有小鼠均为野生型SCN1A。斩首后迅速摘除大脑,用冰凉蔗糖切片人工脑脊液(ACSF)进行切片,其中含有85 NaCl、2.5 KCl、1.25 NaH。2阿宝4,25 NaHCO3、25葡萄糖、75蔗糖、0.5 CaCl2和4氯化镁2使用10 MDL-APV和100 MKynurenate在Leica Vibratome上.切片在相同的蔗糖ACSF中培养30°C,30 min后,溶液逐渐交换为含以下(Mm)的ACSF:125 NaCl,2.4KCl,1.2NaH。2阿宝4,25 NaHCO3,25葡萄糖,1 CaCl2,和2 MgCl2室温下含10 mDL-APV和100 mKynurenate.脑片在恢复至少1.5h后转移到记录室,记录海马CA1锥体神经元。当内记录液填充时,记录电极的尖端电阻为3~5MΩ:135 CSCL,20 HEPES,2 EGTA,2mg-ATP,0.5Na-GTP,10 QX-314(pH值7.25)。异步ipSCs(AipSCs)是从α的体周突触记录的。2GABAA受体亚基丰富(野村等)。2019;Prenosil等人。2006)。在记录锶基碱性粒细胞集落刺激因子(−70 mV)的电压钳模式下,记录了以下(Mm)的AIPSCs:125 NaCl,2.4KCl,1.2NaH。2阿宝4,25 NaHCO3,25葡萄糖,6 SrCL2,0.5 CaCl2,和2 MgCl2用兴奋性反应阻滞剂,CNQX(10 M)和D-APV(50 M)与95%O平衡25%CO2。在刺激伪影后的50~500 ms窗内,用ACSF填充的单极细胞外刺激电极诱发体表AIPSCs,并在50~500 ms窗内进行分析(Fernandes等)。2015;Jurgensen和Castillo2015;野村等人。2019;Prenosil等人。2006)。存取电阻(Ra)被持续监视,如果Ra在录制过程中变化超过20%。每只B6/B6小鼠记录4~5个细胞,每只B6小鼠记录3~5个细胞。用Mann Whitney对基因型进行统计比较。U-用Wilcoxon符号秩检验(GraphPad Prism)对试验和配对数据进行比较。数据为平均值±扫描电镜。
8周生存监测
SCN1A+/−有B6/129或编辑/129等位基因的小白蚁GABRA 2断奶后,取4~5只同龄、同性别的小白鼠,断奶。生存期至8周。在此期间,所有的老鼠每天都被监测到一般的健康状况。所有记录在案的死亡都是突然和意外的,发生在其他健康的动物身上(SUDEP样)。这与原始遗传图谱所用的表型相同(Miller等人)。2014)。在基因型范围内,首先比较性别间的存活率。未发现性别差异,因此,各性别组被倒倒,以分析基因型效应。生存统计采用logrank Mantel-Cox检验(GraphPad Prism)进行时间-事件分析.
发作表型
SCN1A+/−携带B6/129或Eded/129的小白鼠GABRA 2如上文所述,对自发性全身性强直阵挛发作(GTCS)的等位基因进行了监测(Hawkins等人)。2007年a)。简单地说,在P18或P19时,小鼠接受一次短暂的(<1分钟)高温诱导的GTCS,然后立即冷却到基线温度。如果未发生GTCS,则将小鼠排除在研究之外(<1%),以确保所有SCN1A+/−在研究中的小鼠有一个类似的基线与初始的“启动性癫痫”。将2到3只混合基因型和性别的小鼠置于监测笼中。亚锂获得标准的啮齿类食物和水。自发的GTCS频率被连续视频监控捕获,如前面所描述的(Hawkins等人)。2007年a, 2016)。从午夜开始(启动后12~16h)连续监测12~14天(278~336 h),直至突然死亡。这个窗口捕捉到了德拉维小鼠模型中最高的癫痫发作期(Cheah等人)。2013;Favero等人。2018;Miller等人。2014;Mistry等人。2014;Oakley等人。2009)。视频的评分离线,审查人员盲于基因型,以确定自发GTCS的频率和严重程度。每只小鼠的总发作次数除以监测的总小时数,然后转换为每24小时的发作频率。SCN1A+/−模型如下:(1)饲养和划桨、无其他运动的斯特劳布尾巴;(2)饲养和划桨、斯特劳布尾巴、姿势丧失、运动短发(经常是向后);(3)以狂跑和/或跳跃方式饲养和划桨,不失去姿势;(4)以野生跑步和/或跳跃的方式饲养和划桨,失去姿势;(5)用野生跑和/或跳跃的方式饲养和划桨,使姿态下降,使后肢伸直(HLE);(6)以狂奔和(或)跳跃的方式饲养和划桨,失去姿势,发展到补药HLE,最终以死亡告终。采用卡方检验,比较各组小鼠在各评分类别中的数量。根据每个GTCS事件是否存在补剂HLE期,确定每只小鼠5~6期癫痫发作的比例,并按基因型平均比例。首次比较了基因型内性别间的癫痫发作频率和平均HLE比例。未发现性别差异,因此,各性别组被倒倒,以分析基因型效应。采用Mann Whitney U-试验(GraphPad Prism)比较不同基因型的癫痫发作频率和平均HLE比例.数据表示为平均值±扫描电镜。
结果
在我们之前的基因图谱研究中,我们提名了GABRA 2作为顶Dsm1候选修饰基因影响SCN1A+/−小鼠,并提出观察到的差异表达GABRA 2在129和B6之间是可能的机制(Hawkins等人)。2016)。我们显示了鲁棒的应变依赖性差异表达,这种表达不受基因型的影响(WT v.SCN1A+/−)相同的菌株(Hawkins等人)。2019, 2016)。微分表达式GABRA 2发作前出现(P14),发作后持续(P24)(补充图)。(Hawkins等人)2019)。此外,GABRA 2最近的癫痫发作事件(RNA分离前<24小时)没有改变表达(补充图)。S1a)(Hawkins等人。2019)。其他海马GABA的表达Aα亚基转录本(Gabra 1,Gabra 3,Gabra 4,Gabra 5)在129和B6之间或基因型之间没有差异(WT v.SCN1A+/−)(补充图。S1b)(Hawkins等人。2019)。在并行工作中,我们将B6的低表达归因于仅存在于当前B6基因组中的单核苷酸内含子缺失(Mulligan等人)。2019)。通过CRISPR/Cas9编辑修复b6特异性变异体GABRA 2再次匹配其他小鼠品系,包括129种。(无花果)1(Mulligan等人)2019)。恢复表达的B6小鼠GABRA 2(编辑)提供了一个确定的资源来检验以下假设:GABRA 2表达式负责Dsm1修饰效应甚至使我们能够定位于亲本间特定核苷酸差异的影响。
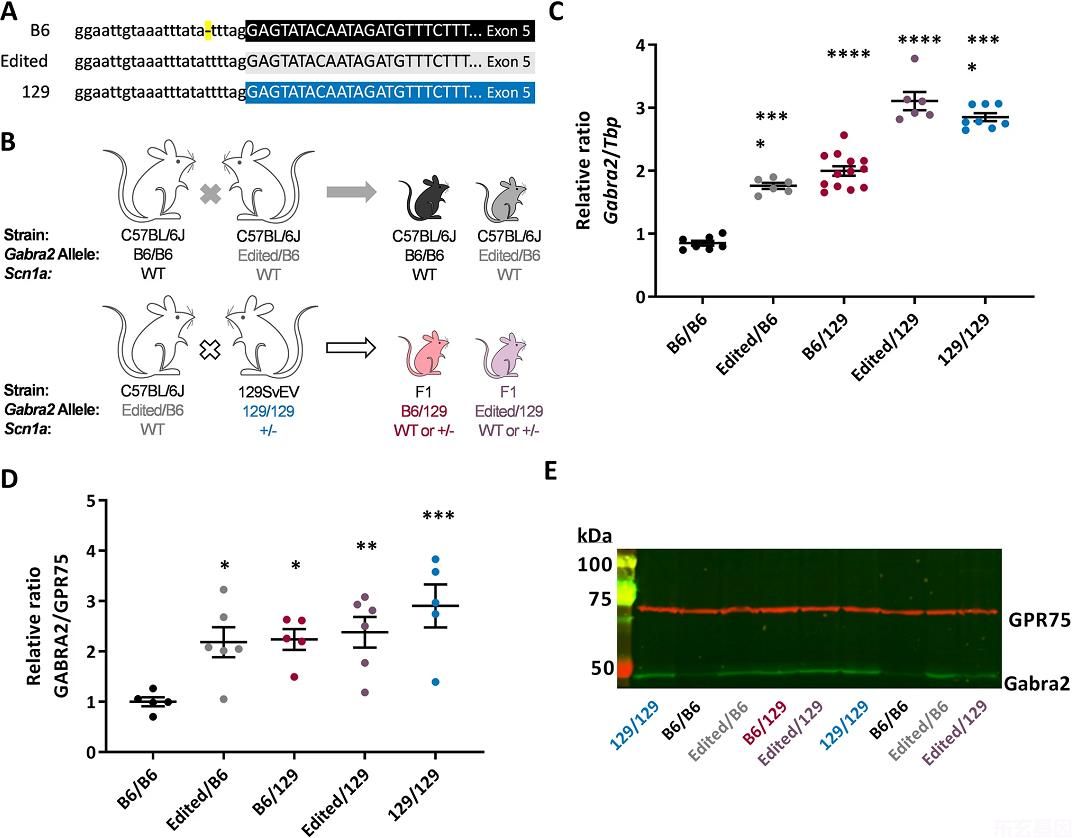
单核苷酸修复GABRA 2增加转录和蛋白表达
我们首先确认修理GABRA 2(编辑/B6)与129菌株杂交时,等位基因特异性表达发生改变(图1)。1b)。我们评估了野生型(WT)小鼠的转录和蛋白表达,其等位基因如下GABRA 2*B6/B6、Eded/B6、B6/129、Eded/129或129/129(图1)。1b)。GABRA 2不同基因型之间的转录表达差异(F4, 35=104.5,p < 0.0001, One-way ANOVA) (Fig. 1c)。B6/B6、129/B6和129/129等位基因特异性表达差异与以往报道一致(Hawkins等人)。2019, 2016;Miller等人。2014;Yu等人。2020)。表达GABRA 2编辑/B6和B6/129的转录本较B6/B6升高了1.8倍(p<0.0001,Dunnett‘s);GABRA 2Eded/129和129/129的表达水平较B6/B6高出3倍(图6/B6)。1(C)(p < 0.0001, Dunnett’s). GABRA2 protein expression followed the same pattern as transcript and differed between genotypes, (F4, 22=5.349,p=0.0037,单向方差分析(图1)。1D,e)。GABRA 2在编辑/B6和B6/129中的表达比B6/B6高约2.2倍(p<0.03,Dunnett‘s),而在Edited/129和129/129中的表达比B6/B6高出约2.6倍(p<0.03,Dunnett’s)。p < 0.01, Dunnett’s) (Fig. 1D,e)。这些结果表明B6的修复GABRA 2等位基因规范化转录和蛋白表达水平可与129相当,这与我们先前的标准化表达报告一致(Mulligan等人)。2019).
单核苷酸修复GABRA 2改变神经元表型
我们先前证明,海马CA1神经元的体周抑制性突触含有更多的含α2的GABA。A129只小鼠与B6小鼠的受体比较(野村等)。2019)。α2 GABAA受体介导的电流可以通过使用选择性α来区分。2/α3正变构调节剂AZD 7325对α2亚基(野村等)富集的抑制性突触后电流的衰减动力学有较大影响。2019)。确定编辑等位基因是否影响突触GABAA受体,记录B6/B6和EditedB6小鼠CA1神经元的IpSCs。应用细胞外Sr去同步诱发IPSCs2+从而可以记录异步量子GABA能事件(AIPSCs)。在对照组和应用AZD 7325(100 Nm)后,通过刺激锥体层(SP)记录体周突触的aIPSCs,并测量电流衰减时间(图1)。2)。B6/B6小鼠的AIPSCs在对照期平均基线衰减为7.07±0.28ms,Edited/B6小鼠的AIPSCs在基线期间平均衰减为6.89±0.51ms。AZD 7325能延长B6/B6小鼠切片的AIPSC衰减时间(8.76±0.35 ms)。p=0.0002,Wilcoxon)和Edited/B6小鼠(9.576±0.64ms),p=0.0010,Wilcoxon)。然而,AZD 7325在编辑/B6切片的记录中效果显著,比B6/B6增加了140±5.3%,而B6/B6则增加了125±2.6%。2D,p=0.047,曼-惠特尼)。提示与B6/B6小鼠相比,EDITED/B6小鼠的CA 1能突触在α2受体中富集。与我们以前的报告一致(野村等人)。2019AIPSC的振幅不受基因型(p=0.12,Mann Whitney)或AZD 7325管理局(B6/B6:p=0.94;B6/编辑:p=0.70;Wilcoxon)(图1)。2(B6/B6基线:58.1±3.1 Pa,n=13;B6/B6后:102±3.6%;编辑/B6基线:68.5±4.7 Pa,n编辑/B6级:100.6±4.2%)。此外,AIPSC频率(B6/B6基线:6.56±0.56Hz;B6/B6后:6.92±0.44Hz;EditedB6基线:7.10±0.87Hz;EditedB67.37±0.59Hz)不受基因型(p>0.999,Mann-Whitney)或AZD 7325(B6/B6)p=0.33,编辑/B6p=0.50,Wilcoxon)。这些结果表明b6的修复是特异性的。GABRA 2含α2基因的GABA等位基因规范化功能表达ACA1周围GABA能突触中的受体,可能是通过改变亚基组成而不是改变周围GABA的数目来实现的A受体。

图2
单核苷酸修复GABRA 2改善F1表型。SCN1A +/−小鼠
129.SCN1A+/−小鼠没有明显的无缘无故的癫痫发作或过早死亡表型,而F1。SCN1A+/−小鼠有自发性发作和过早死亡(康等人)。2018;Miller等人。2014;Ogiwara等人。2007;Yu等人。2006)。类似地,用间隔特异的同型(ISC)菌株进行定位表明,该基因的129个等位基因具有纯合性。GABRA 2该区域可以挽救其他F1的癫痫发作和猝死表型。SCN1A+/−小鼠(Hawkins等人)。2016)。为了进一步完善基因机制,我们研究了b6特异性基因的修复。GABRA 2内含子变异能提高F1的存活率。SCN1A+/−老鼠。我们杂交B6小鼠进行杂合子修复GABRA 2(B6/编辑)至129。SCN1A+/−生成F1。SCN1A+/−携带编辑/129或B6/129等位基因的小鼠GABRA 2(无花果)1b)。F1代存活率提高。SCN1A+/−具有编辑/129和B6/129等位基因的小鼠GABRA 2 (p < 0.0001, Logrank Mantel-Cox). Mice with Edited/129 alleles had 97% (32 of 33) survival to 8 weeks of age compared to only 43% (13 of 30) of mice with B6/129 alleles (Fig. 3(A),支助GABRA 2作为修饰基因在Dsm1该位点最初是以8周存活作为主要表型进行定位的(Miller等人)。2014).
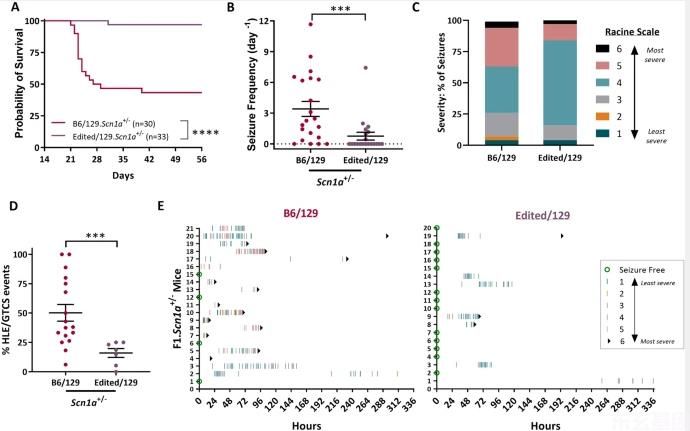
图3
接下来,我们调查了GABRA 2变异改变发作频率和/或严重程度。在P18-19,F1。SCN1A+/−具有编辑/129和B6/129等位基因的小鼠GABRA 2被试接受单一的高温引发癫痫发作,并迅速冷却至基线温度(Hawkins等人)。2007年a)。我们以前证明过,这种模式提高了F1的癫痫发生率。SCN1A+/−小鼠和改善识别能力,以确定癫痫减少(Hawkins等人。2007年a, 2007年b)。重要的是,发作温度在Eded/129组(41.1±0.2°C)和B6/129组(41.2±0.2°C)之间没有差异(P>0.05)。p=0.9127,学生的t-测试),自129以来的预期。SCN1A+/−小鼠也有类似的温度阈值的高温引起的惊厥(补充图)。S2)。Edited/129组和B6/129组小鼠均发生了体温过高所致的启动性惊厥。在癫痫发作后,连续监测小鼠随后的自发性强直-阵挛发作(GTCS)12-14天,直至突然死亡。此窗口与Draview小鼠模型中最高发作频率的时间相吻合(Cheah等人)。2013;Favero等人。2018;Miller等人。2014;Mistry等人。2014;Oakley等人。2009)。F1的比例。SCN1A+/−在监测期间展示GTCS的情况不同GABRA 2基因型(p < 0.0026, Fisher’s exact). Only 35% of mice with Edited/129 alleles exhibited seizures, while 81% of mice with B6/129 alleles had seizures (Fig. 3b)。F1期癫痫发作频率。SCN1A+/−EDITED/129等位基因小鼠(0.8±0.4GTCS/d)低于B6/129等位基因小鼠(3.4±0.7GTCS/d)。3(B)(p < 0.0018, Mann–Whitney).
虽然先前的研究表明发作频率与存活率之间存在相关性,但其他研究表明,总发作频率与存活率之间的关系更为复杂,而发作严重程度是一个关键因素(Kalume等人)。2013、Teran等人。2019)。被记录/目睹的猝死事件SCN1A+/−小鼠完全发生在癫痫发作后,进展到补剂HLE,而高频率的非HLE发作是耐受性的(Hawkins等人)。2007年a, 2007年b;Kalume等人。2013;Kang等人。2019、Teran等人。2019)。因此,我们还使用修改后的racine量表评估癫痫的严重程度。SCN1A+/−德雷维模型。在具有Edited129个等位基因的小鼠群体中,84%的癫痫发作评分为4分或以下,而B6/129等位基因小鼠的癫痫发作率为63%。具有编辑/129个等位基因的小鼠GTCS事件进展到HLE的比例低于B6/129等位基因的小鼠(50±7%)(16±4%)。p=0.0007,Mann-Whitney)(图1.3c,d)。癫痫发作日记图显示了每只老鼠及其各自的发作事件(图1)。3e)。这些数据一起证明了B6的修复GABRA 2等位基因降低F1的癫痫负荷。SCN1A+/−老鼠,支持GABRA 2作为导致修饰符效应的基因与Dsm1轨迹。
讨论
在本研究中,我们证明GABRA 2是修饰基因Dsm1F1与129菌株依赖生存差异的原因SCN1A+/−小鼠归因于Dsm1(Hawkins等人)2016;Miller等人。2014)。此外,我们还定义了修饰效应背后的负责任的核苷酸差异。B6特异性单核苷酸内含子缺失的编辑GABRA 2与129个等位基因相关的正常脑转录和蛋白表达,增加含α2的GABA含量A受体在海马突触,并显着改善癫痫发作和突发性死亡(SUDEP样)表型的F1。SCN1A+/−德拉维老鼠模型。这项工作有明确的治疗意义,并建议干预增加中枢神经系统的表达或功能的GABRA 2应该改善结果的德拉韦综合征。此外,GABRA 2最近还被提名为一种基于小鼠模型遗传图谱的生存调节剂。SCN8A-相关的Dee(Yu等人)。2020)。因此,治疗的含义可能更广泛地适用于其他疾病。
在先前的工作中,我们和其他人展示了鲁棒的等位基因特异性表达。GABRA 2(Hawkins等人)2019, 2016;Mulligan等人。2019, 2012;Yu等人。2020)。此外,我们还发现GABRA 2蛋白的异常低表达是由C57BL/6J基因组中的非编码单核苷酸缺失引起的,这种缺失改变了剪接效率(Hawkins等人)。2007年b;Korostynski等人。2006;Mulligan等人。2019, 2012;Yeo等人。2016)。B6小鼠是最常用的实验小鼠品系,是第一次进行测序(GRCm 38)。随着下一代测序技术的急剧改进,从孝(F)代204-207小鼠中产生的GRCm 38参考基因组与目前的(F 226)B6小鼠株(Fairfield等)可能有所不同。2015;Sarsani等人。2019)。最近,Sarani等人。测序C57BL/6 JEVE,“母亲”(F 223)目前实验室B6动物来源于杰克逊实验室(F 226)(Sarsani等人)。2019)。该小组确定了B6-EVE和GRCm 38之间的59个indels和反转体,其中许多位于非编码的内含子区域(Sarsani等人)。2019)。此外,杰克逊实验室最近的努力确定了GRCm 38参考序列与最近几代C57BL/6J近交系序列之间的1083个质量控制筛选变异(Fairfield等人)。2015)。与其他自交系相比,这些变异体可以提供对B6基因组中私有的denovo变异的深入了解。在研究包括癫痫在内的疾病的基因修饰时,这是特别有趣的。另一个最近的例子B6特异性的denovo变异,作为一种遗传修饰的癫痫是C50T变异在神经元tRNAn-TR20。C50T变异导致低水平的n-TR20水平,这与增强WT小鼠的癫痫易感性和提高棘波放电发生率有关。Gabrg 2R43Q缺阵癫痫小鼠模型(Ishimura等人)。2014;Kapur等人。2020).
同时编辑特定于C57BL/6J的GABRA 2等位基因改善了DRAVET样表型F1的许多方面。SCN1A+/−特征并没有减弱为良性129。SCN1A+/−表型,仍可观察到自发性发作。这并不令人意外,因为我们最初绘制了Draview生存修饰符的遗传图谱(DSM)识别的多个位点(Dsm1-5),具有129个等位基因的保护作用。Dsm1位点占表型变异的4-10%(Miller等人)。2014)。就.而言Dsm1的大小GABRA 2等位基因效应与我们先前利用间隔特异性同型小鼠进行的精细作图研究相似,存活率分别提高到98%或92%,重度HLE发作减少55%或42%(Hawkins等人)。2016)。这表明GABRA 2是Dsm1轨迹。的三个附加修饰语位点SCN1A+/−表型(Dsm2, Dsm3, DSM 5)尚未得到调查(Miller等人)。2014)。对B6特异性私有变异体的初步研究可能会提示在Draview综合征小鼠模型中有更多的候选修饰基因。此外,我们先前的rna-seq研究表明,菌株对SCN1A+/−突变,我们和其他人已经证明,癫痫本身可以诱导额外的稳态重塑(Dutton等人)。2017;Favero等人。2018;Hawkins等人。2007年a, 2019;Salgueiro-Pereira等人。2019).
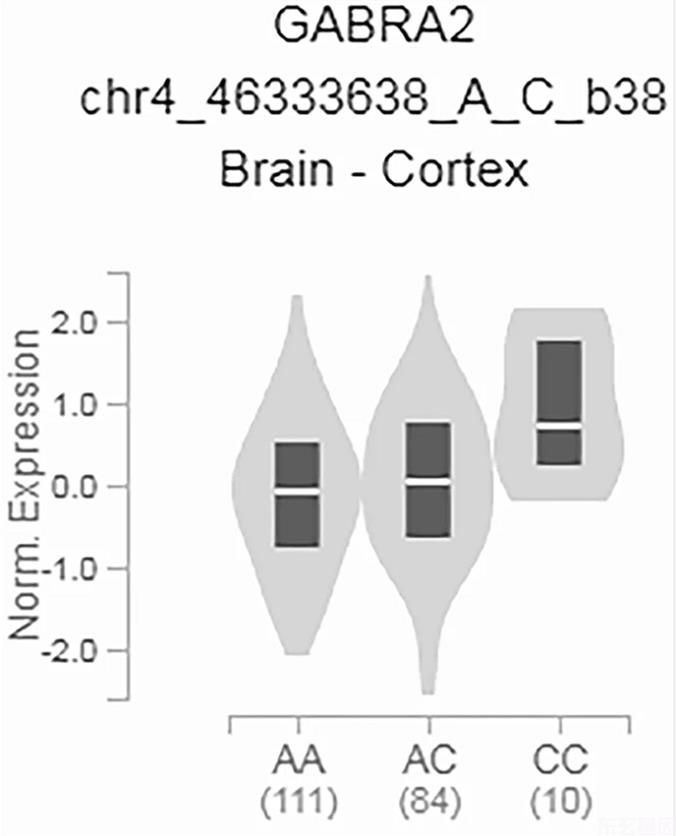
本研究的一个潜在局限性是B6中的单核苷酸缺失是一种小鼠特异性变异体,在人类中不存在。然而,对人体组织的研究已经确定了多个eQTLGABRA 2,表达水平随遗传变异而变化。例如,单核苷酸多态性rs279829的总等位基因频率(MAF)为0.2325,东亚人群的MAF为0.5259,而非洲人群的MAF为0.05706(Karczewski等人)。2020)。小等位基因的纯合子携带者增多。GABRA 2相对于主要等位基因杂合子或纯合子个体的表达(如图所示)。4)(GTEx联合会2015)。因此,自然变化GABRA 2基因的表达可能导致Draview综合征和其他癫痫表型的变化,并可能参与针对GABA的药物的治疗反应。A受体。虽然我们没有明确阐明α2受体的恢复改变抑制平衡的确切机制,但可能主要是由α2受体介导的,而AZD 7325在B6/编辑小鼠中的差异效应支持了这一作用。在B6/编辑的小鼠中,iPSC的基线特性没有差异,这并不排除这种可能性。即使α2亚基被完全敲除,IPSC的振幅和动力学也不会改变(Panzanelli等人)。2011)。这表明大部分GABAA这些突触的受体是α1和α2亚基的异构组合,α1亚基在支配突触电流特性方面占主导地位。与我们之前的研究相一致(野村等人。2019)AZD 7325处理在不影响幅度的情况下,对延长周围神经干细胞的衰变动力学有较大的作用,表明B6/编辑小鼠在这些突触中α2的活性有不同的贡献。
有趣的是,虽然自发性癫痫和早逝有很强的应变依赖性,但紧张依赖并不延伸到热疗引起的癫痫发作。SCN1A+/−F1和129株小鼠的阈值温度相似。这表明129个等位基因改变了癫痫的风险,而不是提供完全的保护,而高温是一个强烈的挑衅者。SCN1A突变。这可能对临床前筛查有影响,因为相对于自发癫痫监测,体温升高可能是一种更严格的条件。
这项研究强调了持续努力在小鼠模型中识别修饰基因的重要性。几种癫痫修饰基因,包括CACNA1G和GABRA 2,首先在SCN1A+/−小鼠Draview综合征模型,后来被证实为人类癫痫危险基因(Bergren等人)。2005, 2009;Butler等人。2018;Calhoun等人。2016, 2017;Chemin等人2018;冯等人。2019霍金斯和科尔尼2012, 2016;Hawkins等人。2011, 2016;Hernandez等人。2016;Kearney等人。2006;Miller等人。2014)。识别修饰基因可以提供对遗传病分子基础的深入了解。为进一步提高疾病病程预测和临床管理提供了依据。最后,修饰基因和途径可以为治疗提供新的靶点。以前,我们使用的是AZD 7325,一种GABA。Aα2/α3选择性PAM对大鼠神经细胞表型的调节作用SCN1A+/−小鼠,并显示了对高温所致惊厥的保护作用(野村等人)。2019)。目前的研究证实AZD 7325可以用来区分GABA。A在周围突触的受体类型,并直接表明,编辑的等位基因参与了丰富的α2亚基含量。未来的研究评估AZD 7325或其他GABRA 2选择性PAMs治疗自发性癫痫和存活的疗效,将为靶向α提供进一步的支持。2-含GABAA作为一种共同的致病机制,用于治疗Draview综合征的受体和其他共享GABAergic信号的DEE可能会减少GABAergic信号。